Stabiliteit van meropenem in een draagbare medicatiecassette omgeven door koelelementen
- Rubriek: Oorspronkelijk artikel
- Identificatie: 2024;9:a1776
Kernpunten
- De korte chemische stabiliteit van meropenem bemoeilijkt het gebruik in de poliklinische setting.
- De chemische stabiliteit kan worden verlengd wanneer meropenem wordt opgelost in gekoeld natriumchloride 0,9% en de medicatiecassette omgeven wordt door bevroren koelelementen, die elke 12 uur worden vervangen.
- Meropenem kan als continu infuus worden gebruikt in de poliklinische setting, mits aan bovenstaande voorwaarden wordt voldaan.
Abstract
Stability of meropenem infusions in a portable medication cassette stored in a bag enclosed by cooling elements
Background
Meropenem is a parenteral β-lactamase resistant broad spectrum carbapenem antibiotic. After dissolution, it is relatively unstable. Therefore, in the outpatient setting, it cannot be stored nor given as prolonged (continuous) infusion at room temperature.
Objective
The aim of this study was to investigate the chemical stability of meropenem solutions in a medication cassette packed in a bag enclosed by cooling elements (changed every 12 hours), stored at room temperature for 24 hours.
Design and methods
Meropenem was reconstituted and diluted with cold 0.9% sodium chloride (4.3 °C) to obtain solutions with concentrations of 12 mg/mL (n = 3) and 24 mg/mL (n = 3) in portable 250 mL CADD medication cassettes. Cassettes were individually enclosed by two frozen cooling elements and stored at room temperature for 24 hours. Cooling elements were changed every 12 hours. Samples were taken at t = 0 followed by a sample every 3 hours during 24 hours. Samples were analysed using a validated stability indicating high performance liquid chromatography with diode array detection method. Solutions retaining > 90% of the initial concentration were considered stable.
Results
All tested samples showed a meropenem concentration > 90% of the initial concentration. No degradation products were found.
Conclusion
The results demonstrate that meropenem continuous infusion can be used in outpatient setting when above-mentioned conditions are met.
Inleiding
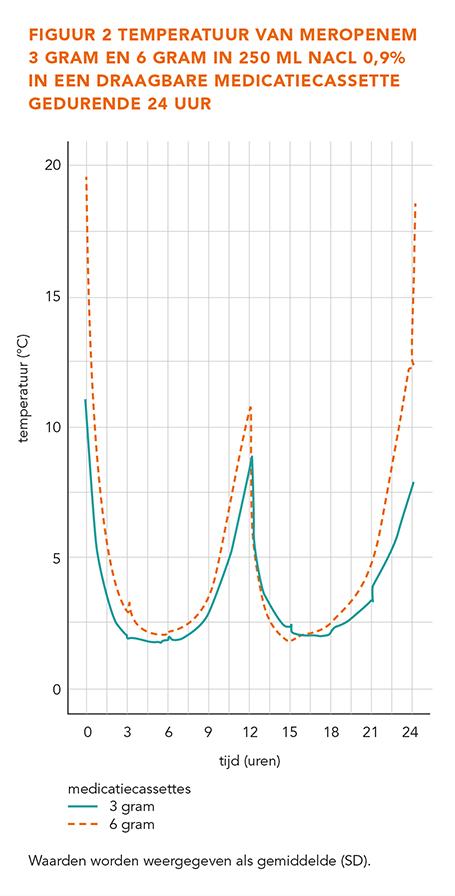
Meropenem is een betalactamase resistent carbapenem antibioticum en alleen in parenterale toedieningsvorm beschikbaar. Het heeft een breed spectrum antibacteriële activiteit tegen de meerderheid van zowel gram-positieve als gram-negatieve ziekteverwekkers [1,2]. De klinische effectiviteit van meropenem is aangetoond voor de behandeling van verschillende infecties in de buikholte, de urinewegen en de lagere luchtwegen [3]. Meropenem is geregistreerd om intermitterend (elke 8 uur) als een kortdurend infuus (gedurende 15-30 minuten), of als een bolus (tot 20 mg/kg) te worden toegediend [4]. Echter, toediening van betalactam-antibiotica via een continu infuus, inclusief meropenem, wint aan populariteit ter optimalisatie van de farmacodynamiek. De werkzaamheid van carbapenem-antibiotica hangt af van de tijd die de concentratie beschikbaar heeft om de minimale remmende concentratie (%T > MIC) van het te bestrijden micro-organisme te overschrijden. Er is literatuur die aantoont dat de klinische uitkomst voor kritisch zieke patiënten verbetert wanneer carbapenem-antibiotica worden toegediend via een continu infuus in plaats van intermitterend [5].
Intermitterend doseren in een poliklinische setting is arbeidsintensief en praktisch veelal niet te realiseren met thuiszorginstanties Outpatient Parental Antimicrobial Therapy (OPAT). Het gebruik van een continu infuus met eenmaal dagelijkse infuuswisseling voor de toediening van antibiotica is een praktische methode voor de poliklinische setting. Echter, de stabiliteit van het geneesmiddel moet gedurende de gehele toedieningsperiode (minimaal 24 uur) kunnen worden gegarandeerd. Alleen op die manier krijgt de patiënt voldoende actief geneesmiddel binnen voor een effectieve behandeling, zonder te worden blootgesteld aan mogelijke afbraakproducten. Meropenem heeft als kenmerk dat het een relatief instabiele stof is wanneer het wordt gebruikt in opgeloste vorm [6]. Dit kenmerk leidt tot onzekerheid over de stabiliteit bij toepassing in de poliklinische setting [7,8]. Veel onderzoekers hebben de chemische stabiliteit van meropenem onderzocht (zie tabel 1). De instabiliteit van meropenem wordt door verschillende factoren veroorzaakt. Ten eerste wordt de stabiliteit beïnvloed door het oplosmiddel dat wordt gebruikt om het geneesmiddel te reconstitueren. Meropenem is stabieler wanneer het wordt gereconstitueerd met water voor injecties of met natriumchloride (NaCl) 0,9% dan met glucose 5% [9,10]. Ten tweede is de concentratie het meest stabiel in een concentratiebereik van 1-20 mg/mL; geconcentreerdere oplossingen (> 40 mg/mL) zijn minder stabiel (zie tabel 1) [6,7,9]. De derde factor die de stabiliteit van meropenem beïnvloedt is de bewaartemperatuur. Het blijkt dat meropenem stabieler is in oplossingen die opgeslagen worden bij 4-5 °C vergeleken met oplossingen die bij een hogere temperatuur worden bewaard, zoals bij 21-26 °C (zie tabel 1) [9-11]. Aangezien meropenem onvoldoende lang stabiel is bij kamertemperatuur, wordt een continu infuus gedurende 24 uur in de poliklinische setting beschouwd als een onacceptabele keuze voor het afleveren van meropenem. Echter, het gebruik van gekoelde meropenemoplossingen kan een manier zijn om deze beperking te overkomen. De meropenemoplossingen moeten dan wel worden verpakt in een zak omgeven door koelelementen, welke iedere 12 uur worden vervangen. Het kan daarom een mogelijk alternatief zijn om meropenem als een continu infuus gedurende 24 uur toe te dienen onder de bovengenoemde voorwaarden. Er moet opgemerkt worden dat deze conclusie alleen zal gelden voor de specifiek onderzochte situatie en gekozen materialen. Voor zover wij weten, zijn er tot nu toe twee onderzoeken naar de stabiliteit van meropenem in een medicatiecassette, verpakt in een zak omgeven door koelelementen, uitgevoerd. In deze onderzoeken werden de koelelementen elke 8-12 uur vervangen in een omgeving met kamertemperatuur [8,12]. Manning et al. onderzochten de stabiliteit van meropenem met concentraties van 10 en 20 mg/mL in medicatiecassettes waarvan de koelelementen elke 8 uur werden vervangen. Grant et al. bestudeerden de stabiliteit van meropenem met concentraties van 20 en 30 mg/mL in medicatiecassettes waarvan de koelelementen elke 12 uur werden vervangen. In dit laatste onderzoek werden hogere concentraties gebruikt dan de meest gebruikte in de klinische praktijk (12 en 24 mg/mL). Omdat in het eerste onderzoek de koelelementen iedere 8 uur werden vervangen en in het tweede onderzoek ongebruikelijke concentraties zijn onderzocht, was het doel van dit onderzoek om de chemische stabiliteit van gekoeld meropenem in een draagbare medicatiecassette te onderzoeken, waarbij de medicatiecassette is omgeven door koelelementen die iedere 12 uur worden vervangen. Het geheel wordt gedurende 24 uur opgeslagen bij kamertemperatuur.
Methoden
Chemicaliën
Zowel meropenem 1000 mg poeder voor oplossing voor injectie of infuus (lot nr. MNL1119) en NaCl 0,9% (g/v) 250 mL oplossing voor infuus (lot nr. 13PCF112) werden verkregen van Fresenius Kabi Nederland BV (Huis ter Heide).
Materialen
CADD medicatiecassette reservoirs van 250 mL werden gebruikt (lot nr. 3943965, ref 21-7308-24, Smiths Medical ASD, Inc. Minneapolis, USA). De medicatiecassette bestond uit een zak gemaakt van polyvinylchloride Tris (2-Ethylhexyl) Trimellitate (PVC TOTM) en een PVC-lijn. De medicatiecassette werd niet bevestigd aan een pomp.
Stabiliteitsonderzoek
Om op theoretische gronden de meest optimale uitgangsvoorwaarden te leveren, werden koude startmaterialen van NaCl 0,9% gebruikt, aangezien meropenem stabieler is bij lagere dan bij hogere temperaturen [9,11]. De infuuszakken die gebruikt zouden worden voor oplossing en verdunning werden twee dagen voor aanvang van het experiment in de koelkast geplaatst bij een gemiddelde temperatuur van 4,3 °C (range 4,0-5,7 °C). Meropenem injectieflacons van 1000 mg werden gereconstitueerd met 20 mL koude NaCl 0,9% met gebruik van een steriele plastic wegwerpspuit (Original perfusor syringe 50 mL Luer Lock, B. Braun, Melsungen AG, Germany). Deze oplossing werd verder verdund met koude NaCl 0,9% (4,3 °C) 250 mL oplossing voor infuus, wat resulteerde in een concentratie van 12 mg/mL (3000 mg in 250 mL) en 24 mg/mL (6000 mg in 250 mL).
Medicatiecassettes werden in drievoud gevuld met de twee concentraties, wat resulteerde in totaal zes medicatiecassettes. Lucht werd volledig uit de draagbare medicatiecassette gezogen met behulp van een steriele plastic wegwerpspuit die ook werd gebruikt voor het vullen van de 250 mL medicatiecassette. Daarna werden de medicatiecassettes gedurende 24 uur in een aparte draagtas geplaatst (stof, niet-geïsoleerd materiaal), die ook twee koelelementen bevatten (Koolit Refrigerants, item: 00001257, batch: 4694941, Cold Chain technologies, Franklin, MA, USAC). De koelelementen werdengedurende twee dagen voor aanvang van het experiment bewaard in de vriezer (gemiddelde temperatuur van de vriezer −21,6 °C [range −23,7 - −18,5 °C]). De koelelementen hadden hetzelfde formaat (15 x 15 cm) als de medicatiecassette en werden aan beide zijden van de medicatiecassette geplaatst. Na 12 uur werden de koelelementen vervangen. De lijn van de medicatiecassette werd buiten de zakken geplaatst, omdat dit het beste de klinische praktijk nabootst en omdat de monsters uit deze lijn zouden worden gehaald. Verder werd een temperatuurmeter (ATAL model ATV-05, 15931063) in de medicatiecassette geplaatst tussen de harde buitenwand en de PVC TOTM binnenzak van de medicatiecassette. Hiervoor werd een opening gemaakt in de rechteronderhoek van de medicatiecassette, om de temperatuur zo dicht mogelijk bij de vloeistof te kunnen meten. De temperatuurmeter mat de temperatuur elke vijf minuten gedurende een periode van 24 uur. De medicatiecassette verpakt in een door koelelementen – één aan beide zijkanten van de medicatiecassette – omgeven niet-geïsoleerde draagtas werd in een omgeving van ongeveer 20 °C geplaatst om de temperatuur in de thuissituatie na te bootsen. Om een continue infusie na te bootsen bij een patiënt die een pompinstelling had van 10,3 mL/u (31 mL/3u), werd elke drie uur eerst 29 mL opgezogen met gebruik van een 30 mL spuit en verworpen, gevolgd door het opzuigen van een 2 mL monster voor analyse, met behulp van een 3 mL steriele plastic wegwerpspuit (BD Luer-Lok Tip, lot: 9164852, ref: 309658, Fisher Scientific, Hampton, USA). Onmiddellijk na monstername werden de monsters opgeslagen bij een temperatuur van –80 °C [25]. In totaal werden 54 monsters verkregen. De monsters werden op droogijs naar het laboratorium van de afdeling Klinische Farmacie en Farmacologie van het Universitair Medisch Centrum Groningen verzonden. Daar werden de monsters onmiddellijk opgeslagen in de vriezer bij –80 °C totdat de analyse plaatsvond. De analyses werden 2 weken na het verzamelen van de monsters uitgevoerd.
High Performance Liquid Chromatography met diode array detection
Alle experimenten werden uitgevoerd met behulp van een High Performance Liquid Chromatography-Diode Array Detection ([HPLC-DAD], VWR Hitachi Chromaster system) met een diode array detector (model 5430), een kolomoven (model 5310), een autosampler (model 5210) en een pomp (model 5110). CSM-software versie 2.1 werd gebruikt voor piekoppervlakte-integratie. Voor scheiding werd een LiChrospher 100-5 reversed phase 18e-column (deeltjesgrootte 5 micrometer, 120 x 4 mm) gebruikt. De mobiele fase bestond uit een acetonitril-gebufferde waterige oplossing bestaande uit 150 μL triethylamine en 550 μL fosforzuur 85% aangepast tot pH 3,2 met kaliumhydroxide-oplossing 10% (470: 530, v/v). Als referentie werd meropenem trihydraat verkregen van Sigma-Aldrich (Productnummer M2574, Batchnummer 0000065799, St. Louis, MO). Acetonitril werd verkregen van Biosolve (Valkenswaard), triethylamine buffer substantie en orthofosforzuur 85% waren afkomstig van Merck KGaA (Darmstadt, Duitsland). Alle reagentia waren van analytische kwaliteit. Ultrapuur water werd verkregen van een Milli-Q waterzuiveringssysteem (Millipore SAS, Molsheim, Frankrijk). De stroomsnelheid van de mobiele fase werd op 0,6 mL/min gezet wat resulteerde in een kolomdruk van ongeveer 6 MPa. De retentietijd voor meropenem was 1,33 minuten. Monsters opgeslagen bij −80 °C werden binnen 20 minuten geëquilibreerd op kamertemperatuur en gemixt met een Vortex mixer voor aanvang van de analyse. Voor injecteren werden 12 mg/mL monsters 500 keer verdund met mobiele fase en 24 mg/mL monsters werden 1000 keer verdund met mobiele fase. Een hoeveelheid van 20 μL van het verdunde monster werd geïnjecteerd via een gekoelde autosampler (10 °C) in het HPLC-systeem. De kalibratiecurves bestonden uit zeven punten in de range van 5-40 μg/mL.
De correlatiecoëfficiënt voor de kalibratiecurve was 0,999. Negen onafhankelijk gemaakte oplossingen van meropenem werden gebruikt als controle voor zowel 12 mg/mL als 24 mg/mL oplossingen. De negen monsters bestonden uit drie lage (gemiddeld 5,05 mg/L), drie gemiddelde (gemiddeld 20,6 mg/L) en drie hoge (gemiddeld 31,8 mg/L) concentraties in relatie tot de kalibratiecurve. Om de geschiktheid van de chromatografische scheiding te onderzoeken, werd de stabiliteit van meropenem onderzocht onder verschillende stressomstandigheden met HCl 1M, NaOH 1M, H2O2 3% met verhoogde temperatuur (90 °C) en bij kamertemperatuur (21 °C) op dag 1 en 5.
De initiële concentratie van meropenem bij t = 0 werd op 100% gesteld. Alle volgende concentraties werden uitgedrukt als een percentage van de initiële concentratie.
Resultaten
Stabiliteitsstudie
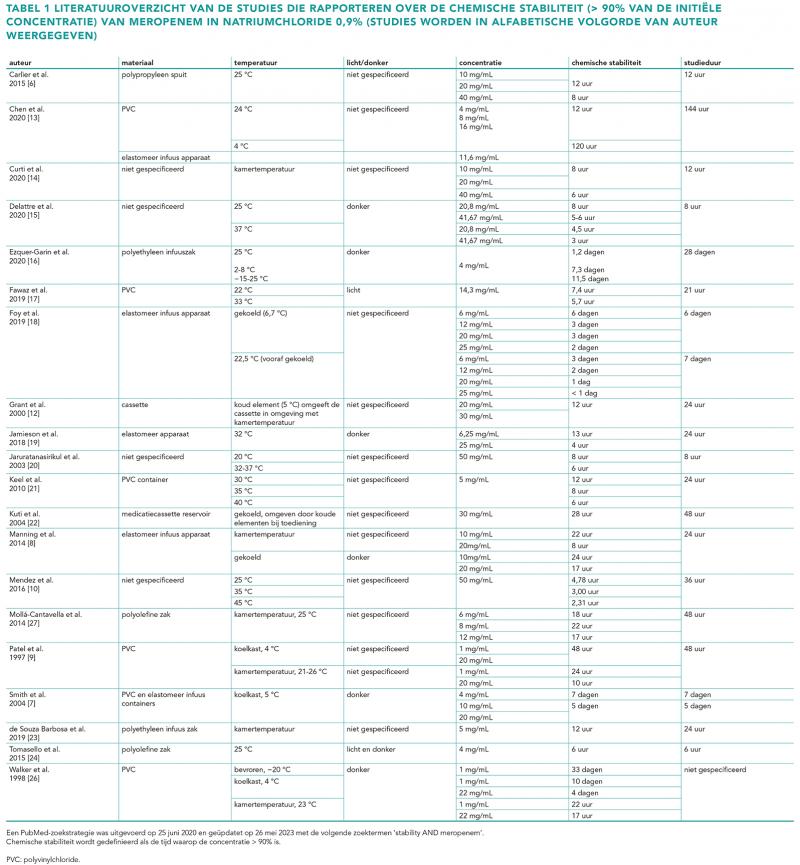
De meetresultaten van de meropenemoplossingen in de medicatiecassettes, zie figuur 1, laten zien dat gedurende 24 uur tenminste 90% van de initiële concentratie behouden blijft.
HPLC-DAD
Voor wat betreft de ontledingspieken, lag de piekzuiverheid tussen de 0,92-0,96 en werden geen afbraakproducten gevonden. De resultaten van de stresstesten toonden aan dat, wanneer vergeleken met het chromatogram onder normale condities, met stresscondities met H2O2 3% bij kamertemperatuur een afwijkend spectrum kan worden waargenomen op dag 1. Ten tweede, afbraak kan worden waargenomen in de afwijkende pieken in het chromatogram. Wanneer het chromatogram onder normale condities wordt vergeleken met degene onder stresscondities met HCl bij 90 °C op dag 2, kan afbraak worden waargenomen in de pieken in het chromatogram. De controlemonsters lagen binnen de 5% van de nominale waarde. Om de vries-dooi cycli te valideren, waren monsters (concentratie van 20,6 mg/mL) stabiel met een bias van 1,9% bij verdunning; de variatiecoëfficiënt (binnen de run) was 0,4%. De meropenem piek op het HPLC-chromatogram toonde geen afwijking ten opzichte van een controle-chromatogram.
Temperatuuruitlezingen
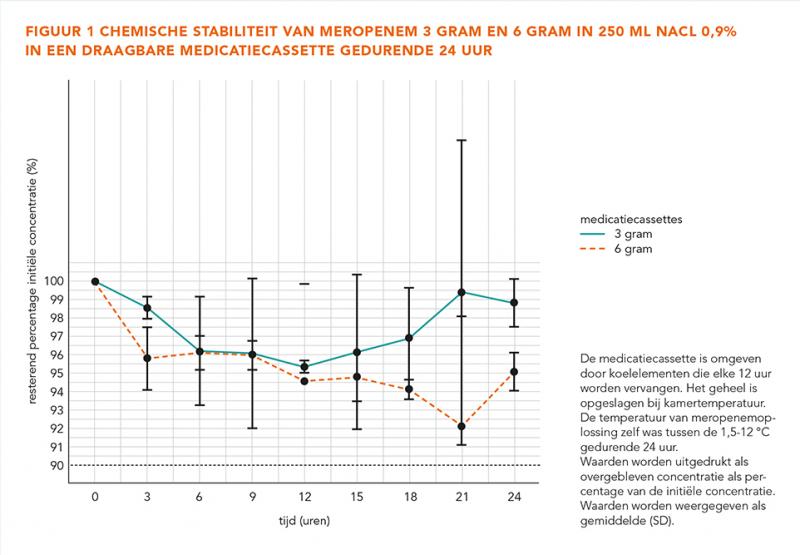
In figuur 2 is de temperatuur van meropenem 3 gram en 6 gram in 250 mL in de medicatiecassette gedurende 24 uur te zien. Het elke 12 uur vervangen van de koelelementen resulteert in de vorm van een parabool. Aanvankelijk daalt de temperatuur tot ongeveer 1,5 °C en stijgt daarna tot maximaal 10,9 °C.
Beschouwing
Het doel van deze studie was om de chemische stabiliteit van meropenem te onderzoeken in gekoelde medicatiecassettes in een omgeving met kamertemperatuur. De koelelementen, gebruikt voor het koelen van de medicatiecassette, werden elke 12 uur vervangen. Deze medicatiecassette werd bewaard in een draagtas die dient als transportmedium. Deze studie toont dat meropenem, verdund in koude NaCl tot een concentratie van 12 en 24 mg/L in een draagbare medicatiecassette en welke 24 uur lang gekoeld werd middels de beschreven methode, stabiel was gedurende 24 uur bij kamertemperatuur. De resultaten van deze studie tonen aan dat meropenem als continu infuus kan worden toegediend in de poliklinische setting wanneer aan de bovengenoemde voorwaarden wordt voldaan. Deze resultaten liggen in lijn met de bevindingen van eerder gepubliceerde onderzoeken (zie tabel 1). Onze resultaten, namelijk stabiliteit gedurende 24 uur, kwamen overeen met die van Manning et al. [8]. Grant et al. vermeldden een kortere stabiliteit (12 uur), hetgeen mogelijk te wijten is aan de gebruikte hogere concentratie in vergelijking met onze studie. Een hogere concentratie wordt geassocieerd met een snellere afbraak [12].
Twee andere studies onderzochten de stabiliteit van bevroren meropenem in medicatiecassettes, waarbij de medicatiecassettes werden ontdooid en koel gehouden tot de toediening en gekoeld met koelelementen tijdens de toediening. Bevriezen voor het koel houden en omgeven door koelelementen verlengde de stabiliteit van meropenem 25 mg/L en 30 mg/L naar een totaal van 48 en 28 uur respectievelijk [18,22].
Ten slotte levert tabel 1 ook een overzicht van verschillende stabiliteitsstudies van meropenem opgeslagen in een koelkast. Zowel Walker et al. [26] en Patel et al. [9] rapporteerden stabiliteit van meropenem gedurende 48 uur tot 5 dagen voor dezelfde concentraties als welke werden gebruikt in onze studie [9]. In combinatie met de resultaten uit de literatuur (zie tabel 1), maakt onze studie de weg vrij om een houdbaarheid toe te kennen aan meropenem medicatiecassettes van 5 dagen, waarvan 4 dagen opgeslagen in de koelkast en een 24-uurs toediening onder gekoelde omstandigheden. Gebaseerd op onze studie is er een afname van 5% in concentratie te zien na 24 uur onder gekoelde omstandigheden. Daarnaast rapporteren studies uit de literatuur (zie tabel 1) ook een afname van 5% wanneer meropenem opgeslagen wordt in de koelkast gedurende 4-5 dagen. Gebaseerd op de bovengenoemde waarnemingen kan een meropenemconcentratie van > 90% van de initiële concentratie worden gegarandeerd gedurende 5 dagen.
Onze studie heeft enkele beperkingen. Ten eerste was er geen pomp bevestigd aan de medicatiecassette. Voor dit gebrek is echter gecorrigeerd door elke drie uur 29 mL te verwijderen voor afname van een monster. Ten tweede moet worden opgemerkt dat deze conclusie alleen zal gelden voor de specifiek onderzochte situatie en gekozen materialen, te denken valt aan de draagtas/koelelementen-combinatie inclusief het invriesproces. Dus wanneer andere uitgangscondities of materialen worden gekozen, moet een audit worden uitgevoerd om te bepalen of de temperatuur in de medicatiecassette overeenkomt met de temperatuur in onze studie om dezelfde houdbaarheid te kunnen toekennen. Onze studie toont dat wanneer de temperatuur rondom koelkasttemperatuur (2-8 °C) wordt gehouden, de stabiliteit van meropenem kan worden gegarandeerd. Ten derde, aangezien onze studie een in vitro studie was, werd de draagzak geplaatst op de tafel in plaats van aangesloten aan de patiënt. Daarom konden de werkelijke OPAT voorwaarden niet perfect worden gesimuleerd. Ten vierde, was in onze studie de omgevingstemperatuur laag met 19 °C. Deze temperatuur komt niet overeen met zomerse omstandigheden waarbij het veelal warmer zal zijn. Ten slotte moet worden opgemerkt dat in figuur 1 één grote spreiding te zien is rond 21 uur na het starten van het experiment in alle drie de medicatiecassettes met 12 mg/L meropenem. Variatie in analysemethode zou mogelijk kunnen hebben bijgedragen aan deze variatie.
Conclusie
Meropenem gereconstitueerd en verdund tot een concentratie van 12 en 24 mg/mL met koude NaCl (4,3 °C) was gedurende 24 uur stabiel bij kamertemperatuur, indien verpakt in een niet-geïsoleerde draagtas met koelelementen waarbij de condities van koelkasttemperatuur konden worden gewaarborgd gedurende de infusieduur. De resultaten van deze studie tonen aan dat meropenem continue infusie kan worden gebruikt in een ambulante setting wanneer aan bovengenoemde voorwaarden is voldaan. Bovendien maakt onze studie, in combinatie met gegevens uit de literatuur, het mogelijk om de meropenem medicatiecassettes een houdbaarheid van 5 dagen toe te kennen, waarvan 4 dagen bewaard in de koelkast en 24 uur toegediend onder gekoelde omstandigheden.
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Pfaller MA, Jones RN. A review of the in vitro activity of meropenem and comparative antimicrobial agents tested against 30,254 aerobic and anaerobic pathogens isolated world wide. Diagn Microbiol Infect Dis. 1997 Aug;28(4):157-163.
2. Blumer JL. Meropenem: evaluation of a new generation carbapenem. Int J Antimicrob Agents. 1997 Mar;8(2):73-92.
3. Wiseman LR, Wagstaff AJ, Brogden RN, Bryson HM. Meropenem. A review of its antibacterial activity, pharmacokinetic properties and clinical efficacy. Drugs. 1995 Jul;50(1):73-101.
4. SmPC Meropenem Fresenius Kabi 1 g poeder voor oplossing voor injectie of infusie [internet]. Utrecht: College ter Beoordeling van Geneesmiddelen (CBG); 2022 juli 29 [geraadpleegd 2023 september].
https://www.geneesmiddeleninformatiebank.nl/smpc/h105441_smpc.pdf
5. Dulhunty, JM, Roberts JA, Davis JS, et al. Continuous infusion of beta-lactam antibiotics in severe sepsis: a multicenter double-blind, randomized controlled trial. Clin Infect Dis. 2013 Jan;56(2):236-244.
6. Carlier M, Stove V, Verstraete AG, De Waele JJ. Stability of generic brands of meropenem reconstituted in isotonic saline. Minerva Anestesiol. 2015 Mar;81(3):283-287.
7. Smith DL, Bauer SM, Nicolau DP. Stability of meropenem in polyvinyl chloride bags and an elastomeric infusion device. Am J Health Syst Pharm. 2004 Aug 12;61(16):1682-1685.
8. Manning L, Wright C, Ingram PR, et al. Continuous infusions of meropenem in ambulatory care: clinical efficacy, safety and stability. PLoS One 2014 Jul 14;9(7):e102023.
9. Patel PR, Cook SE. Stability of meropenem in intravenous solutions. Am J Health Syst Pharm. 1997 Feb 15;54:412-421.
10. Mendez AS, Dalomo J, Steppe M, Schapoval EE. Stability and degradation kinetics of meropenem in powder for injection and reconstituted sample. J Pharm Biomed Anal. 2006 Jun 16;41(4):1363-1366.
11. Berthoin, K, Le Duff CS, Marchand-Brynaert J, Carryn S, Tulkens PM. Stability of meropenem and doripenem solutions for administration by continuous infusion. J Antimicrob Chemother. 2010 May;65(5):1073-1075.
12. Grant EM, Zhong MK, Ambrose PG, Nicolau DP, Nightingale CH, Quintiliani R. Stability of meropenem in a portable infusion device in a cold pouch. Am J Health Syst Pharm. 2000 May 15;57:992-995.
13. Chen IH, Martin EK, Nicolau DP, Kuti JL. Assessment of Meropenem and Vaborbactam Room Temperature and Refrigerated Stability in Polyvinyl Chloride Bags and Elastomeric Devices. Clin Ther. 2020 Apr;42(4):606-613.
14. Curti C, Souab HK, Lamy E, et al. Stability Studies of Antipyocyanic Beta-Lactam Antibiotics Used in Continuous Infusion. Die Pharmazie. 2019 Jun 1;74:357-362.
15. Delattre IK, Briquet C, Wallemacq P, Tulkens PM, Van Bambeke F. Comparative in vitro antimicrobial potency, stability, colouration and dissolution time of generics versus innovator of meropenem in Europe. Int J Antimicrob Agents. 2020 Jan;55(1):105825.
16. Ezquer-Garin C, Ferriols-Lisart R, Martinez-López LM, Sangrador-Pelluz C, Nicolás-Picó J, Alós-Almiñana M. Stability of tedizolid phosphate-sodium rifampicin and tedizolid phosphate-meropenem admixtures in intravenous infusion bags stored at different temperatures. Die Pharmazie. 2020 May 1;75:172-176.
17. Fawaz S, Barton S, Whitney L, Swinden J, Nabhani-Gebara S. Stability of Meropenem After Reconstitution for Administration by Prolonged Infusion. Hosp Pharm. 2019;54(3):190-196.
18. Foy F, Luna G, Martinez J, et al. An investigation of the stability of meropenem in elastomeric infusion devices. Drug Des Devel Ther. 2019 Aug 1;13:2655-2665.
19. Jamieson C, Allwood MC, Stonkute D, Wallace A, Wilkinson AS, Hills T. Investigation of meropenem stability after reconstitution: the influence of buffering and challenges to meet the NHS Yellow Cover Document compliance for continuous infusions in an outpatient setting. Eur J Hosp Pharm. 2020;27:e53-e57.
20. Jaruratanasirikul S, Sriwiriyajan S. Stability of meropenem in normal saline solution after storage at room temperature. Southeast Asian J Trop Med Public Health. 2003 Sep;34:627-629.
21. Keel RA, Sutherland CA, Crandon JL, Nicolau DP. Stability of doripenem, imipenem and meropenem at elevated room temperatures. Int J Antimicrob Agents. 2011 Feb;37:184-185.
22. Kuti JL, Nightingale CH, Knauft RF, Nicolau DP. Pharmacokinetic properties and stability of continuous-infusion meropenem in adults with cystic fibrosis. Clin Ther. 2004 Apr;26(4):493-501.
23. de Souza Barbosa F, Capra Pezzi L, Tsao M, et al. Stability in clinical use and stress testing of meropenem antibiotic by direct infusion ESI-Q-TOF: Quantitative method and identification of degradation products. J Pharm Biomed Anal. 2020 Feb 5; 179: 112973.
24. Tomasello C, Leggieri A, Cavalli R, Di Perri G, D'Avolio A. In Vitro Stability Evaluation of Different Pharmaceutical Products Containing Meropenem. Hosp Pharm. 2015 Apr;50:296-303.
25. Franceschi L, Cojutti P, Baraldo M, Pea F. Stability of generic meropenem solutions for administration by continuous infusion at normal and elevated temperatures. Ther Drug Monit. 2014;36:674-676.
26. Walker SE, Varrin S, Yannicelli DY, Law S. Stability of meropenem in saline and dextrose solutions and compatibility with potassium. Can J Hosp Pharm. 1998;51(4):156-168.
27. Mollá-Cantavella S, Ferriols-Lisart R, Torrecilla-Junyent T, et al.Intravenous meropenem stability in physiological saline at room temperature. Eur J Hosp Pharm Sci Pract. 2014;21:202-7.
Referentie
Citeer als: Mian P, Movig KLL, Koopmans P, Maurer JM, Touw DJ, Nijdam LC. Stabiliteit van meropenem in een draagbare medicatiecassette omgeven door koelelementen. Nederlands Platform voor Farmaceutisch Onderzoek. 2024;9:a1776.
DOI
https://www.knmp.nl/resolveuid/0cc05e65aeb34285a570d4b9e913d19eOpen access

Reactie toevoegen