Medicatieaanpassingen bij 1 op de 3 patiënten naar aanleiding van farmacogenetische bepalingen aangevraagd door Service Apotheken op basis van opgestelde inclusieprotocollen: SA-PGx pilot
- Rubriek: Oorspronkelijk artikel
- Identificatie: 2023;8:a1771
Kernpunten
- Selectie op basis van inclusieprotocollen en de klinische blik van de apotheker ten aanzien van potentiële farmacogenetica-problematiek leiden bij 1/3 van de patiënten tot medicatieaanpassingen.
- Clopidogrel, statines, pantoprazol en metoprolol worden het vaakst aangepast naar aanleiding van het farmacogenetisch onderzoek.
- Het ontbreken van een vergoeding bij aanvraag van farmacogenetisch onderzoek door de apotheker wordt als belangrijkste barrière ervaren bij de implementatie in de dagelijkse praktijk.
Abstract
Medication adjustments in 1 out of 3 patients as a result of pharmacogenetic testing initiated by primary care pharmacists based on specific inclusion protocols (SA-PGx pilot)
Background
Pharmacogenetic analysis is currently performed at 16 certified laboratories in the Netherlands. For 90 different drugs pharmacogenetic advice is available, of which 23 drugs are frequently prescribed in primary care. Despite these opportunities the use of pharmacogenetic testing in primary care is still limited.
Objective
Investigate to what extent pharmacogenetic inclusion protocols and expert opinion of a pharmacist will lead to medication adjustments in patients.
Design
Prospective feasibility cohort study.
Methods
Eligible patients for pharmacogenetic testing are selected based on predefined inclusion protocols or pharmacist’s expert opinion. DNA analysis is performed on buccal swab material collected in the pharmacy. Questionnaires, regarding drug-related complaints and patient satisfaction concerning provided care in the pharmacy, are filled in by the patients at baseline and after 1-2 weeks (no medication adjustments) or after 6 weeks (medication adjustments). Following study completion the application of pharmacogenetic testing is evaluated by the participating pharmacists.
Results
Over a period of 2 years 86 patients were included within 10 primary care pharmacies. Medication changes based on pharmacogenetic results were registered in 25 patients (29%). Almost 1/3 of these patients were selected based on the inclusion protocols. The most frequently changed drugs were clopidogrel, statins, pantoprazole and metoprolol. Drug complaints were reduced in 19% (n = 3) of the patients (not significant). The lack of imbursement in case of pharmacogenetic test requests from pharmacists was the most frequently mentioned barrier towards broad implementation of pharmacogenetics in primary care pharmacy.
Conclusion
Pharmacogenetic requests initiated by the pharmacist lead to medication adjustments in 30% of the patients with potentially also improvement in the pharmacotherapy. Barriers such as imbursement require attention in order for pharmacogenetics to be applied more broadly in the primary care pharmacy.
Inleiding
De uitspraak ‘one size does fit all’ volstaat al een ruime tijd niet meer bij de medicamenteuze behandeling van patiënten. Er zijn diverse toepassingen waarbij de farmacotherapie wordt geïndividualiseerd op basis van patiëntkenmerken (onder andere nierfunctie en HER2 genetische analyse) of externe factoren (onder andere comedicatie en roken). De optimalisatie van geneesmiddeleffectiviteit en het verminderen van toxiciteit is onder andere ook te bereiken middels de farmacogenetica. Bij farmacogenetisch onderzoek wordt achterhaald of patiënten een genetische aanleg hebben voor een afwijkende afbraaksnelheid van geneesmiddelen en daardoor naar verwachting een hoger risico hebben op onderbehandeling (bij verhoogde afbraak) of juist toxiciteit (bij verlaagde afbraak). Bij deze bepalingen worden genetische variaties in het DNA van enzymen (bijvoorbeeld Cytochroom P450, dihydropyrimidinedehydrogenase [DPD] en thiopurine S-methyltransferase [TPMT]) en geneesmiddeltransporterende eiwitten (zoals Organic Anion Transporter Protein 1B1 [OATP1B1], coderend gen Solute Carrier Organic Anion Transporter Family Member 1B1 [SLCO1B1]) bepaald.
Momenteel zijn voor ruim negentig geneesmiddelen medicatieadviezen opgesteld door de Werkgroep Farmacogenetica van de KNMP, waaronder een aanzienlijk deel van de medicatie ook in de eerste lijn wordt voorgeschreven. Deze medicatieadviezen zijn via de G-Standaard beschikbaar in het apotheekinformatiesysteem (AIS) [1]. Stichting Health Base levert vergelijkbare adviezen aan het AIS Pharmacom [2]. Ten minste 95% van de patiënten in Nederland heeft één afwijking in één van de genen waarvoor medicatieadvies op basis van de farmacogenetica voorhanden is [3]. Uit een nationale enquête is echter gebleken dat aanvragen van farmacogenetica-diagnostiek door apothekers beperkt is, waarbij slechts 14,7% van de apotheken ‘wel eens’ een farmacogenetische test heeft aangevraagd [4]. Hierbij vond de aanvraag voornamelijk plaats in de ziekenhuissetting, implicerend dat de toepassing in de eerste lijn nog minder is.
Mogelijke redenen voor de beperkte toepassing van farmacogenetica in de apotheek zijn:
- het ontbreken van farmacogenetische profielen in het AIS;
- het gebrek aan en/of onzekerheid over de benodigde kennis, de kosten of vergoeding die gepaard gaan met de aanvraag;
- de afhankelijkheid van de apotheker om via de arts een aanvraag te doen en medicatiewijzigingen door te voeren wanneer dit nodig blijkt;
- het ontbreken van richtlijnen voor het selecteren van patiënten voor farmacogenetisch onderzoek en de vertaling naar een passend medicatieadvies voor de patiënt (in aanwezigheid van andere factoren zoals interacterende comedicatie).
Service Apotheek heeft, in samenwerking met Erasmus MC in Rotterdam, een studie opgezet om te inventariseren in hoeverre een apotheekinterventie gericht op het adviseren van één of meerdere farmacogenetische bepalingen op basis van vooraf opgestelde protocollen en expert opinion van de apotheker leidt tot één of meerdere medicatie- en/of doseringswijzigingen: de SA-PGx pilot. Daarnaast wordt beoogd te achterhalen tegen welke problemen apothekers aanlopen tijdens het aanvragen van farmacogenetisch onderzoek.
Methoden
De SA-PGx pilot betreft een prospectief cohortonderzoek naar de implementatie van farmacogenetica binnen de openbare farmacie. Patiënten komen in aanmerking indien zij 18 jaar of ouder zijn, een levensverwachting hebben van minimaal 1 jaar, ingeschreven zijn bij een openbare apotheek die is aangesloten bij de Service Apotheek-formule en een medicatievoorschrift krijgen van de huisarts of medisch specialist. Patiënten die wilsonbekwaam zijn worden geëxcludeerd. De patiënt heeft twee weken bedenktijd nadat deze is benaderd door de apotheker voor het onderzoek. Bij akkoord deelname wordt de toestemming schriftelijk vastgelegd.
De selectie en inclusie van patiënten die in aanmerking komen voor het farmacogenetisch onderzoek vindt plaats door middel van vooraf opgestelde medicatiespecifieke protocollen (inclusieprotocollen A1, A2, A3, B en C) of op basis van de inhoudelijk beoordeling van de apotheker tijdens een medicatiereview of ander gesprek met de patiënt (inclusieprotocol D). Het farmacogenetisch onderzoek wordt aangevraagd door de apotheker bij het regionale farmacogenetica laboratorium, mits afnamekits voor wangslijmvlies of speekselverzameling beschikbaar zijn. Indien deze afnames niet mogelijk zijn, dan wordt het farmacogenetisch onderzoek aangevraagd bij het Nederlands Expertisecentrum Farmacogenetica, afdeling Klinische Chemie van het Erasmus MC in Rotterdam.
De patiënt vult bij aanvang onderzoek (baseline) een vragenlijst in betreffende bijwerkingen van de medicatie en ervaring met de apotheek. Deze vragenlijst, aangevuld met vragen omtrent het farmacogenetisch onderzoek, wordt 1-2 of 6 weken na ontvangst van de uitslag van het farmacogenetisch onderzoek weer opnieuw ingevuld. Voor de vragenlijsten op baseline en follow-up (t = 1-2w, t = 6w) zie appendix A; beschikbaar als PDF onderaan dit artikel, sectie Downloads. Wanneer geen medicatieaanpassingen worden doorgevoerd naar aanleiding van het farmacogenetisch onderzoek, omdat het niet nodig is of omdat de voorschrijver of patiënt dit niet wil, wordt aan de patiënt gevraagd om binnen 1-2 weken de vragenlijst in te vullen. Bij aanpassingen van de medicatie wordt de vragenlijst ‘follow-up’ na 6 weken door de patiënt ingevuld.
Het onderzoek is door de Medisch Ethische Toetsings Commissie Erasmus MC afgegeven als niet-WMO plichtig (MEC-2019-0247).
Inclusieprotocollen
Om de apothekers handvatten te bieden bij de selectie van de patiënten waarbij farmacogenetisch onderzoek potentieel relevant is, zijn vijf inclusieprotocollen op geneesmiddelniveau opgesteld. Een overzicht van de inclusieprotocollen is weergegeven in figuur 1. Binnen elk protocol wordt een specifiek geneesmiddelgerelateerd probleem benaderd (bijvoorbeeld metoprolol en CYP2D6 poor metabolizers). Naast de vijf inclusieprotocollen op geneesmiddelniveau is een algemeen inclusieprotocol opgesteld voor het screenen bij alle overige potentieel farmacogeneticagerelateerde problematiek. De apothekers zijn vrij in hun selectie van de inclusieprotocollen, waarbij wordt gestreefd naar tien inclusies per apotheek.
Patiënten met een lage dosering metoprolol (12,5 en 25 mg) en < 70 jaar worden geselecteerd via inclusieprotocol A1. Middels dit protocol worden potentiële CYP2D6 intermediate en poor metabolizers (IM en PM) opgespoord. De geselecteerde patiënten worden beoordeeld op leeftijd, dosering, afleverhoeveelheden, ophaalfrequentie en comedicatie. Bij patiënten die om een ‘onverklaarbare’ reden deze lage dosering krijgen, wordt een memo op patiëntniveau geplaatst bij een voorschrift van een geneesmiddel waar farmacogenetica-advies voorhanden is in de G-Standaard voor CYP2D6 IM of PM. Op het moment van start studie waren dat: tramadol, amitriptyline, codeïne, tamoxifen, aripiprazol, atomoxetine, clomipramine, flecaïnide, haloperidol, propafenon, venlafaxine, doxepine, imipramine, nortriptyline, pimozide en zuclopentixol. Bij een voorschrift van één van deze geneesmiddelen wordt een CYP2D6-genotypering aangevraagd.
Binnen protocol A2 vindt de patiëntenselectie plaats aan de hand van chronisch gebruik (> 3 maanden) tramadol in een hoge dosering (> 300 mg/dag). In tegenstelling tot A1 wordt bij dit inclusieprotocol direct een farmacogenetische test geadviseerd. Bij een CYP2D6 IM of PM wordt een alternatieve pijnstiller geadviseerd die niet hoofdzakelijk via CYP2D6 wordt afgebroken.
CYP2D6 ultrarapid metabolizers (UM) worden opgespoord door selectie van hoge doseringen metoprolol (> 200 mg/dag). Binnen dit inclusieprotocol (A3) geldt ook dat het farmacogenetisch onderzoek in overleg met arts en patiënt meteen kan worden aangevraagd, zodat bij een CYP2D6 UM een alternatief bloeddrukverlagend geneesmiddel kan worden gestart.
Binnen inclusieprotocol B worden patiënten geselecteerd op basis van een lage dosering simvastatine of atorvastatine (≤ 10 mg/dag) en leeftijd < 70 jaar, met als doel een verlaagde OATP1B1 transporteractiviteit opsporen.
Indien bij de betreffende dosering onvoldoende LDL-verlaging is, kan in overleg met de CVRM-hoofdbehandelaar het farmacogenetisch onderzoek worden aangevraagd. Bij een verlaagde OATP1B1 activiteit wordt rosuvastatine of pravastatine geadviseerd.
Potentiële CYP2C19 UM’s worden via selectie op hoge doseringen omeprazol of pantoprazol (> 2 dagdoseringen gedurende minimaal 6 maanden) opgespoord (inclusieprotocol C). Binnen deze selectie wordt gecontroleerd bij wie deze hoge doseringen nog onvoldoende effectief zijn. Voor deze patiënten is het zinvol direct farmacogenetisch onderzoek aan te vragen zodat bij een CYP2C19 UM een alternatieve protonpompremmer (PPI, esomeprazol of rabeprazol) kan worden voorgeschreven.
Alle overige problematiek waarbij farmacogenetica mogelijk een rol speelt, wordt ondervangen in inclusieprotocol D. Deze inclusie vindt plaats op basis van bevindingen tijdens een medicatiebeoordeling of een ander patiëntgesprek. Hierbij wordt rekening gehouden met de gen-geneesmiddelinteracties uit de G-Standaard.
Resultaten
Binnen een periode van 2 jaar (oktober 2019 t/m oktober 2021) zijn 86 patiënten via tien apotheken geïncludeerd in de SA-PGx pilot. De deelnemende apotheken bestaan uit losstaande apotheken (n = 4) en apotheken gevestigd in een gezondheidscentrum (n = 6), variërend
in grootte van < 5000 (n = 1), 7500-10.000 (n = 3), 10.000-12.500 (n = 2), en > 12.500 (n = 4) patiënten per apotheek. De apotheken zijn gevestigd in steden (n = 5) en dorpen (n = 5) in de provincies Friesland, Groningen, Utrecht, Overijssel en Zuid-Holland.
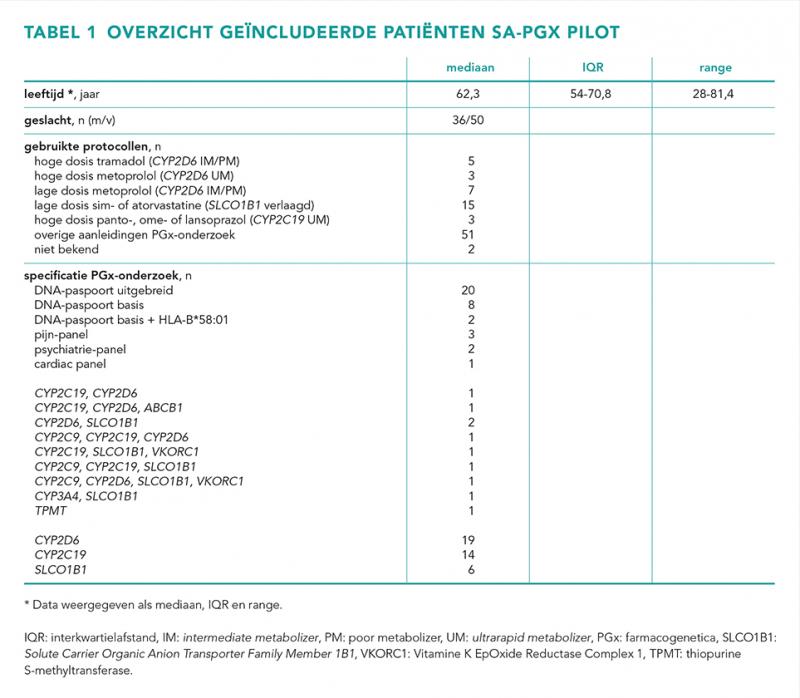
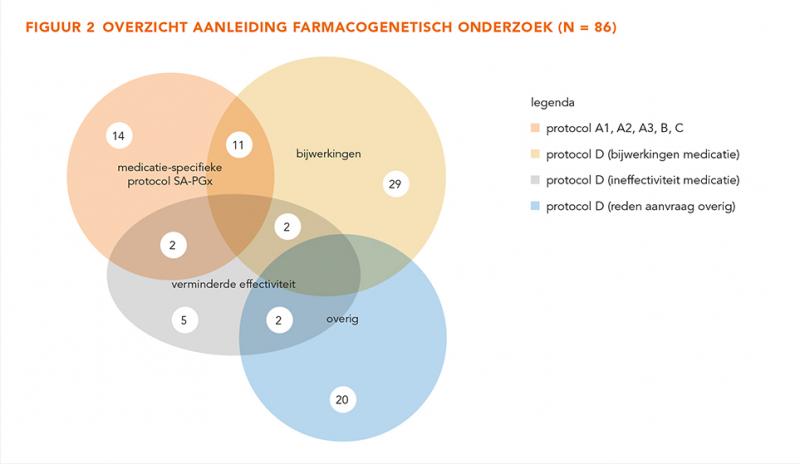
Een beschrijving van de geïncludeerde patiënten is weergegeven in tabel 1. Het overgrote deel van de patiënten is tussen de 54 en 71 jaar. De aanleidingen voor inclusie zijn weergegeven in figuur 2. De meest voorkomende reden voor het aanvragen van farmacogenetisch onderzoek is vanwege bijwerkingen op medicatie (n = 43; 50%). Aanleidingen die vallen onder ‘overig’ zijn voornamelijk (start) clopidogrelgebruik (n = 10). Tevens valt onder ‘overig’ ook toekomstig gebruik medicatie (n = 3), allopurinol (n = 2), mogelijke start bètablokker (n = 1), gebruik metoprolol, clopidogrel en statine (n = 1), geschikte pijnstilling vinden (n = 1), verhoogde spiegels medicatie (n = 1) en mislukte switch van antidepressiva (n = 1). Bij drie aanvragen is de reden van aanvraag niet nader gespecificeerd.
Het aantal geïncludeerde patiënten per inclusieprotocol en de aangevraagde bepalingen zijn weergegeven in tabel 1. Middels de opgestelde inclusieprotocollen zijn in totaal 27 van de 86 patiënten (31%) geïncludeerd, waarbij inclusieprotocol B (SLCO1B1) de meeste patiënten (n = 15) heeft opgeleverd. De drie inclusieprotocollen die betrekking hebben op CYP2D6-genotypering (A1 t/m A3) hebben samen geleid tot vijftien inclusies. Vanwege aanleidingen volgend uit inclusieprotocol D (Overige), waar ook CYP2D6-genotypering was aangevraagd, is CYP2D6 de meest aangevraagde losstaande bepaling (n = 19). De aanleiding voor het aanvragen van een individuele CYP2C19-genotypering (n = 14) is voornamelijk vanwege start of gebruik van clopidogrel (n = 8), bijwerkingen van antidepressiva (n = 3) en het PPI inclusieprotocol C (n = 3). De meest aangevraagde panels zijn: ‘DNA-paspoort uitgebreid’ (CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6, CYP3A4, CYP3A5, VKORC1, SLCO1B1) en ‘DNA-paspoort basis’ (CYP2C9, CYP2C19, CYP2D6, CYP3A4, VKORC1, SLCO1B1) met respectievelijk twintig en tien aanvragen.
Binnen het cohort van 86 patiënten is bij 25 (29%) een medicatie- of dosiswijziging doorgevoerd naar aanleiding van het farmacogenetisch onderzoek. Bij één patiënt wordt de dosis mogelijk nog aangepast. De top 3 meest frequent gewijzigde medicamenten zijn clopidogrel (n = 4), statines (n = 4), pantoprazol (n = 3) en metoprolol (n = 2). 8 patiënten van de 25 (32%) met een medicatie- of dosiswijziging naar aanleiding van het farmacogenetisch onderzoek waren geïncludeerd middels een medicatiespecifiek inclusieprotocol (A1-A3, B, C). Het overgrote deel van de medicatie- of dosiswijzigingen (68%) naar aanleiding van de farmacogenetische testuitslag is het resultaat van inclusieprotocol D, welke refereert naar de expert opinion van de apotheker. Bij aanvragen waar geen medicatie- of dosiswijziging heeft plaatsgevonden (n = 60) was de inclusie via medicatiespecifieke inclusieprotocollen ook 32% (n = 19).
Van de 25 patiënten met een medicatie- of dosiswijziging hebben 16 personen de vragenlijsten betreffende klachten op baseline en follow-up (6 weken na farmacogenetische testuitslag) ingevuld. In tabel 2 is het overzicht op baseline en na 6 weken weergegeven. Bij drie patiënten met klachten op baseline worden geen klachten meer gerapporteerd na de farmacogenetica-interventie (afname 19%, niet significant). Er is geen significant verschil (P = 0,51) in klanttevredenheid voor en na farmacogenetisch onderzoek in de totale groep (mediane score klanttevredenheid voor = 9, interkwartielafstand [IQR]: 8,8-10 versus na = 9, IQR: 8-10; n = 47). In de groep waarbij een medicatie- of dosiswijziging is doorgevoerd (n = 14, door twee personen vraag niet beantwoord) is dit verschil ook niet significant (mediane score klanttevredenheid voor = 10, IQR: 8,8-10 versus na = 9,5, IQR: 9-10).
Bij één van de deelnemende apotheken (met < 5000 patiënten), gevestigd in een gezondheidscentrum, is geregistreerd in hoeverre het advies van de apotheker om farmacogenetisch onderzoek in te zetten ook daadwerkelijk wordt opgevolgd. Uit deze registratie komt naar voren dat bij 8/29 patiënten (28%) het farmacogenetisch onderzoek niet wordt aangevraagd na advies apotheker. De voornaamste reden is ‘geen interesse van de patiënt’ (n = 4; 50%). Bij de overige patiënten is geen farmacogenetisch onderzoek aangevraagd omdat patiënt niet geschikt wordt geacht door huisarts, geen toestemming is afgegeven door patiënt na bedenktermijn, of vanwege Barrett-oesofagus. Bij één patiënt is de reden niet nader gespecificeerd.
Evaluatie toepassing farmacogenetica door apothekers
De ervaringen en tevredenheid over de inclusieprotocollen verschillen onder de groep van tien apothekers. Enerzijds worden de protocollen gezien als een bruikbaar hulpmiddel om geschikte kandidaten te vinden die potentieel profijt kunnen hebben van farmacogenetisch onderzoek. Anderzijds hebben de protocollen niet binnen elke apotheek geleid tot een grote opbrengst aan geschikte kandidaten. Wel wordt door deze apothekers de relevantie van de protocollen aangaande metoprolol en PPI’s benadrukt. Hierbij wordt aangegeven dat beide middelen vaak worden voorgeschreven in de eerstelijnszorg. Daarnaast worden bijwerkingen van metoprolol regelmatig gezien en is de toepassing van het PPI-protocol bruikbaar in het kader van deprescribing PPI’s.
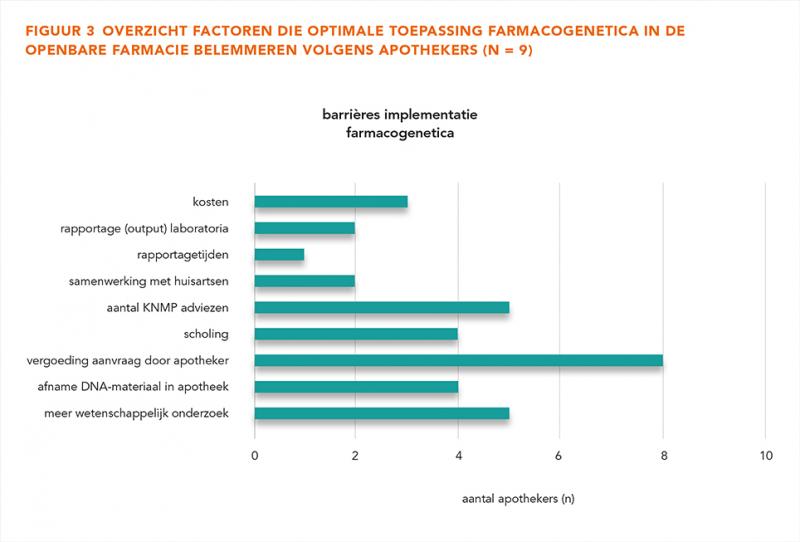
De barrières die de apothekers ervaren bij de toepassing van farmacogenetisch onderzoek zijn weergegeven in figuur 3. Het ontbreken van vergoeding voor farmacogenetisch onderzoek aangevraagd door apothekers wordt gezien als de grootste belemmering (89%). Daarnaast wordt het huidige aantal medicatieadviezen van de KNMP aangaande farmacogenetica als onvoldoende ervaren (56%) en wordt meer wetenschappelijk onderzoek nodig geacht (56%). Op een gedeelde derde plaats wordt scholing en afname van DNA in de apotheek genoemd (44%). Labgerelateerde zaken zoals kosten van een bepaling (33%), rapportage (22%) en rapportagetijden (11%) worden minder frequent als verbeterpunt genoemd. Daarnaast wordt samenwerking met de huisarts ook iets minder vaak als belemmering genoemd (22%).
Beschouwing
Uit de SA-PGx pilot is gebleken dat een apotheekinterventie gericht op het aanvragen van farmacogenetische bepalingen middels inclusieprotocollen en op basis van inzicht van de apotheker, leidt tot medicatie- of dosiswijzigingen bij 29% van de patiënten. Hoe breder farmacogenetische testen worden aangevraagd, hoe groter de kans om ten minste één uitslag met een afwijkend metabolisme te vinden. Zoals eerder aangetoond is bij circa 95% van de bevolking een actionable genotype gevonden wanneer meerdere testen worden uitgevoerd [3]. Een onderzoeksgroep uit Leiden heeft gekeken naar de stand van zaken rondom de implementatie van farmacogenetica in de eerste lijn bij apothekers [5]. Hierbij is binnen een cohort van 200 patiënten gevonden dat het testen van een farmacogenetica-panel bestaande uit acht genen, bij patiënten met een voorschrift van een vooraf geselecteerd geneesmiddel, leidt tot een medicatieaanpassing bij 18% van de patiënten. Binnen de SA-PGx pilot zijn de wijzigingen in medicatie circa 60% hoger, terwijl farmacogenetica-panels van > 3 bepalingen per patiënt minder vaak zijn aangevraagd (43%) dan gerichte aanvragen met één, twee of drie farmacogeneticabepalingen. Door de farmacogenetica-aanvraag te beperken tot een beperkt aantal bepalingen wordt de kans op het vinden van een afwijkend metabolisme verkleind. Echter, door vooraf de patiënten te selecteren met bepaalde geneesmiddelgerelateerde problematiek is de ‘vangst’ groter ondanks de gerichte aanvragen. Dit aspect benadrukt het belang van de gebruikte inclusieprotocollen en de rol van de apotheker in dit zorgproces. Bij de patiënten zonder aanpassingen in de medicatie gaat het waarschijnlijk om andere factoren die van invloed zijn op de medicatieproblemen, of betreft het aanvragen voor start behandeling met clopidogrel. In een viertal gevallen betrof de aanvraag voor algemeen toekomstig medicatiegebruik. Het achterwege laten van deze ‘preventieve’ aanvragen resulteert in een hogere verklaring van de problematiek met medicatie op basis van de farmacogenetica.
De top 3 bestaat uit vier geneesmiddelen die het meest werden gewijzigd naar aanleiding van het farmacogenetisch onderzoek: clopidogrel, statines, pantoprazol en metoprolol. Dit zijn geneesmiddelen, op clopidogrel na, die vaak in de eerste lijn worden voorgeschreven. Bovendien zijn dit de geneesmiddelen uit de medicatiespecifieke inclusieprotocollen. Deze bevinding benadrukt eveneens de klinische relevantie van de protocollen als hulpmiddel bij de selectie van patiënten met potentiële farmacogeneticagerelateerde problemen. Een geautomatiseerd hulpmiddel (signalering vanuit het AIS) gebaseerd op deze protocollen zou wenselijk kunnen zijn ter bevordering van klinisch relevante farmacogenetica-aanvragen.
Een afname van klachten na de medicatie- of dosiswijziging wordt gezien bij 19% van de patiënten. Deze conclusie is echter gebaseerd op een beperkt aantal vragenlijsten (n = 16). Een nadeel van deze pilotstudie is daarmee ook het beperkte aantal patiënten dat is geïncludeerd. De COVID-19-pandemie was, zoals bij velen andere lopende onderzoeken in deze periode, de beperkende factor bij de inclusie. Gezien het relatief kleine aantal geïncludeerde patiënten is het van belang om in een grotere opzet te onderzoeken of de positieve bevindingen uit deze pilot kunnen worden bevestigd. Over de hele groep (met en zonder medicatieaanpassingen) bekeken is geen verschil gezien in gemiddelde klanttevredenheid in de apotheek voor en na farmacogenetisch onderzoek. Hierbij moet worden opgemerkt dat de klanttevredenheid reeds hoog was voor het onderzoek, met een gemiddelde score van 9, waardoor een verbetering slecht te meten zal zijn.
De tien apotheken die hebben deelgenomen aan deze pilot zijn naar verwachting een representatieve selectie van de overige Service Apotheken (bijna vijfhonderd apotheken in totaal) vanwege de geografische spreiding, de variatie in grootte en het feit dat de apotheken bestaan uit een mix van zowel losstaande apotheken als apotheken in een gezondheidscentrum. Door deze verschillen binnen de apotheken die hebben deelgenomen aan dit onderzoek zijn de resultaten overigens representatief voor alle apotheken in Nederland.
Om de toepassing van farmacogenetica uit deze pilot optimaal uit te rollen over de apotheken in Nederland is het cruciaal dat de apotheek een vergoeding ontvangt voor deze additionele zorgtaak. Uit de evaluatie van de apothekers is gebleken dat het ontbreken van vergoeding bij aanvragen via de apotheek vaak (89%) als een struikelblok wordt ervaren bij de implementatie van farmacogenetisch onderzoek in de openbare farmacie. Binnen het project vond altijd vooraf overleg plaats met de huisarts. Op deze manier werd de aanvraag geïnitieerd en uitgevoerd via de apotheker met goedkeuring van de huisarts als zijnde aanvrager. Echter, gezien de mate (89%) waarin apothekers de vergoeding als een belemmering ervaren, is het van belang dat deze vergoedingsstructuur wordt beoordeeld en herzien voor een optimale implementatie van farmacogenetica in de openbare farmacie. Onvoldoende kennis van farmacogenetica en de klinische toepassing worden vaak (90%) binnen enquêtes genoemd als een belemmering bij de implementatie in de praktijk [6]. Dit aspect lijkt met 44% relatief beperkt binnen deze pilot. De kick-off bijeenkomst van de pilot, waarin het onderwerp farmacogenetica is geïntroduceerd, en de e-learning farmacogenetica die is gevolgd, zal hier een belangrijke bijdrage in hebben gehad. Daarnaast zijn medicatiespecifieke inclusieprotocollen binnen deze pilot voorhanden, welke de apotheker handvatten bieden bij het aanvragen van farmacogenetisch onderzoek. Verder kunnen apothekers in Nederland via de beroepsorganisatie KNMP informatie verkrijgen omtrent dit onderwerp, inclusief scholingsmateriaal voor het apotheekteam en FTO-materiaal, wat verder bijdraagt aan het kennisaspect [7]. Tot slot wordt in Nederland ook aandacht besteed aan dit onderwerp binnen de opleiding Farmacie en worden nascholingen aangeboden (onder andere door PAOFarmacie).
Voor een optimale implementatie zijn meer farmacogeneticagestuurde medicatieadviezen nodig en is meer wetenschappelijk onderzoek wenselijk, vindt 56% van de apothekers. Alhoewel voor negentig geneesmiddelen adviezen zijn opgesteld, is het aandeel van geneesmiddelen voorgeschreven in de eerste lijn beperkt tot circa dertig [8]. Mogelijk leiden deze dertig geneesmiddelen minder vaak tot problemen, worden ze minder frequent voorgeschreven in de eerste lijn of wordt een empirisch voorschrijfbeleid gehanteerd. Bij het laatste kan gedacht worden aan het overstappen van simvastatine naar een andere statine vanwege spierklachten. Dit beleid gaat voorbij aan een gepersonaliseerde behandeling en leidt tot onnodige blootstelling aan bijwerkingen of therapiefalen. Toekomstig farmacogenetisch onderzoek zou gericht kunnen worden op de top 25-geneesmiddelen voorgeschreven in de eerste lijn welke het vaakst problemen geven bij patiënten in de praktijk. Indien deze top 25 niet overeenkomt met de geneesmiddelen waarvoor een farmacogenetica-advies is opgesteld, dan biedt dat nieuwe hypotheses voor toekomstig wetenschappelijk onderzoek op het gebied van de farmacogenetica. Binnen deze pilot werd het laboratoriumonderdeel, waaronder de kosten, de rapportage en de rapportagetijden, relatief weinig als een belemmering ervaren door de apothekers. Ten tijde van de inclusie was farmacogenetisch onderzoek middels wangslijmvlies of speeksel beperkt binnen Nederland. Inmiddels bieden diverse laboratoria farmacogenetisch onderzoek aan middels deze niet-invasieve afname, wat bevorderlijk is voor de laagdrempelige implementatie in de openbare apotheek.
Conclusie
Een gerichte aanpak en de professionele beoordeling door de apotheker van potentiële farmacogeneticagerelateerde medicatieproblemen leiden tot een medicatie- of dosisaanpassing bij circa 30% van de patiënten. Het onderzoek wijst uit dat patiënten over het algemeen tevreden zijn over de zorg in de apotheek, onafhankelijk van het farmacogenetisch onderzoek, en een eventuele medicatieaanpassing die op het onderzoek volgt. In hoeverre de medicatieaanpassingen ook tot een vermindering van de geneesmiddelgerelateerde klachten leiden, kon vanwege de kleine aantallen niet worden aangetoond. Om deze vraag te beantwoorden dienen de inclusieprotocollen, bij voorkeur geautomatiseerd in het AIS, in een groter verband te worden onderzocht. Echter, om de optimale implementatie van farmacogenetica in de openbare farmacie te onderzoeken zijn aanpassingen vereist in de vergoedingsstructuur voor de apotheker
Downloads
Verantwoording
Geen belangenverstrengeling gemeld.
Literatuur
1. Medicatiebewaking - Farmacogenetica. KNMP Kennisbank [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie.
https://kennisbank.knmp.nl/article/farmacogenetica/intro.html.
2. Commentaren Medicatiebewaking [Internet]. Houten: Stichting Health Base.
https://www.commentarenmedicatiebewaking.nl.
3. Van Driest SL, Shi Y, Bowton EA, et al. Clinically actionable genotypes among 10,000 patients with preemptive pharmacogenomic testing. Clin Pharmacol Ther. 2014;95(4):423-431.
4. Bank PC, Swen JJ, Guchelaar HJ. A nationwide survey of pharmacists' perception of pharmacogenetics in the context of a clinical decision support system containing pharmacogenetics dosing recommendations. Pharmacogenomics. 2017;18(3):215-225.
5. Bank PCD, Swen JJ, Schaap RD, Klootwijk DB, Baak-Pablo R, Guchelaar HJ. A pilot study of the implementation of pharmacogenomic pharmacist initiated pre-emptive testing in primary care. Eur J Hum Genet. 2019;27(10):1532-1541.
6. Bruno Xuereb AM, Wirth F, Mifsud Buhagiar L, Camilleri L, Azzopardi LM, Serracino-Inglott A. Pharmacist and physician perception of pharmacogenetic testing. Int J Pharm Pract. 2022;30(2):188-191.
7. Dossier Farmacogenetica [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie [geraadpleegd 2022 mrt 4].
https://www.knmp.nl/dossiers/farmacogenetica.
8. Brochure Farmacogenetica en de apotheker, editie februari 2019 [Internet]. Den Haag: Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie [geraadpleegd 2022 mrt 8].
https://www.knmp.nl/media/86
Referentie
Citeer als: Matic M, Denneboom W, Groenendijk W, van Schaik RHN. Medicatieaanpassingen bij 1 op de 3 patiënten naar aanleiding van farmacogenetische bepalingen aangevraagd door Service Apotheken op basis van opgestelde inclusieprotocollen: SA-PGx pilot. Nederlands Platform voor Farmaceutisch Onderzoek. 2023;8:a1771.
DOI
https://www.knmp.nl/resolveuid/f3b06a414c4f4a6ebc801b7c4fb90c40Open access


Reactie toevoegen