Dossiervoering van farmacogenetische uitslagen: een implementatieonderzoek in de Haagse regio
- Rubriek: Korte bijdrage
- Identificatie: 2018;3:a1674
Kernpunten
- Structureren van het proces van vastlegging van farmacogenetisch onderzoek, van aanvraag tot resultaat, leidt tot een betere herleidbaarheid.
- Bij het merendeel van de patiënten (> 50%) is na implementatie van het verbeterplan het farmacogenetisch resultaat vastgelegd, geïnterpreteerd en bewaakt in het elektronisch voorschrijfsysteem, en tevens beschikbaar voor overdracht naar de eerstelijnszorg.
- De beschikbaarheid van de farmacogenetische resultaten in het elektronisch voorschrijfsysteem zal bijdragen aan de medicatieveiligheid.
Abstract
Pharmacogenetic results in the patient’s record: an implementation survey in The Hague
BACKGROUND
Pharmacogenetic testing is becoming increasingly important as it is used in prevention of severe adverse drug reactions, and for optimization of pharmacological therapy for patients with an unexpected response to drugs. In our health care system pharmacogenetics has been introduced since a couple of years. However, the traceability of the pharmacogenetics status in electronic patient files is limited.
OBJECTIVE
To assess, improve and evaluate the process of recording information on the patient’s pharmacogenetic status within the hospital setting.
METHODS
This implementation survey was conducted in two hospitals in The Hague, with an assessment before implementation of structural recording of the pharmacogenetic status in 2015 and an evaluation after implementation in 2017. All patients with a request for pharmacogenetic testing by a physician affiliated with one of the hospitals were included. For each patient we collected data in electronic patient files. The primary outcome was the percentage of patients with a registration of the pharmacogenetic result, both wild-type and mutation, in the hospital information system on patient level.
RESULTS
Of the 193 patients included, none (0%) had their pharmacogenetic results reported in the hospital information system prior to implementation, compared to respectively 94,4% (17 of 18 patients) of the Haaglanden Medisch Centrum and 58,3% (42 of 72 patients) of the HagaZiekenhuis after implementation.
CONCLUSION
In this study 94,4% of the patients from the Haaglanden Medisch Centrum and 58,3% of the patients from the HagaZiekenhuis, had their pharmacogenetic status available in the hospital information system after implementation. Further revisions and research is needed to optimise the process and determine the influence on medication safety.
Inleiding
Desoxyribonucleïnezuur (DNA) fungeert als drager van erfelijke informatie in de vorm van nucleotiden die uiteindelijk resulteren in de aanmaak van enzymen. Door kleine verschillen in deze nucleotiden, ook wel single nucleotide polymorphisms genoemd, kan de functionaliteit van een enzym beïnvloed worden. Enzymen betrokken bij het metabolisme van geneesmiddelen kunnen hierdoor meer of minder actief zijn, waardoor aanpassing van de geneesmiddeldosering nodig kan zijn om over- of onderdosering te voorkomen [1-3].
Het gebruik van farmacogenetica neemt in de individuele farmacotherapie een steeds belangrijkere rol in, zoals in de psychiatrie en de oncologie. Het prospectief bepalen van het dihydropyrimidinedehydrogenase (DPD)-genotype voorafgaand aan behandeling met capecitabine of 5-fluorouracil laat een aanzienlijke afname zien in ernstige bijwerkingen [4,5]. Ook binnen de ouderengeneeskunde is gebleken dat farmacogenetische polymorfismen, waaronder cytochroom P450 2C19 (CYP2C19) en CYP3A4/5, een onafhankelijke risicofactor zijn voor regelmatige ziekenhuisopnames [6,7].
In de G-standaard is sinds 2006 advisering over farmacogenetica opgenomen waarmee het mogelijk is geworden om medicatiebewaking uit te voeren op basis van het genotype van de patiënt [8]. Beschikbaarheid van deze uitslagen in het ziekenhuisinformatiesysteem is essentieel voor juiste interpretatie en medicatiebewaking en overdracht naar de eerste lijn, waarbij zowel het wildtype genotype als een afwijkend genotype kan worden vastgelegd in het apotheekinformatiesysteem [9].
De dossiervoering van farmacogenetisch onderzoek is in de Haagse regio nog niet optimaal georganiseerd. Doordat veel verschillende partijen betrokken zijn, is het belangrijk dat een gestructureerde werkwijze gevolgd wordt. Hiertoe heeft er een verbeterproject plaatsgevonden in twee grote ziekenhuizen. In dit onderzoek is gekeken naar de kwaliteit van het vastleggen van farmacogenetische informatie voor en na implementatie van het verbetertraject.
Methoden
Onderzoeksopzet
Dit implementatieonderzoek werd uitgevoerd in twee ziekenhuizen in Den Haag: het Haaglanden Medisch Centrum (HMC) en het HagaZiekenhuis. Hierbij werden twee metingen uitgevoerd, in respectievelijk 2015 en 2017, voor en na implementatie. Alle patiënten waarvoor een aanvraag voor farmacogenetisch onderzoek werd gedaan door een arts verbonden aan één van de twee ziekenhuizen zijn geïncludeerd. Door middel van statusonderzoek in zowel het laboratoriuminformatiesysteem als het ziekenhuisinformatiesysteem zijn de gegevens per patiënt verzameld.
Verbeterplan
In het verbeterplan is aandacht besteed aan het opzetten van een gestructureerde werkwijze rondom de verwerking van farmacogenetisch onderzoek van aanvraag tot medicatiebewaking. In figuur 1 is het processchema opgenomen van het HagaZiekenhuis. In het HMC is bij implementatie gekozen voor directe communicatie tussen de afdeling klinische chemie en de ziekenhuisapotheek, zonder tussenkomst van het apotheeklaboratorium. De relevante farmacogenetische bepalingen zijn verwerkt in een overzichtstabel met daarbij vooraf gedefinieerde adviesteksten die gebruikt worden bij de vastlegging en interpretatie van de uitslagen. Na verwerking van een uitslag in het laboratoriumsysteem ontvangen de betrokken ziekenhuisapotheken een email met het resultaat om te verwerken en bewaken in het medicatiegedeelte van het ziekenhuisinformatiesysteem, en voor overdracht naar de eerste lijn.
Primaire en secundaire uitkomst
De primaire uitkomst was het percentage patiënten waarbij de farmacogenetische uitslag als contra-indicatie in het ziekenhuisinformatiesysteem was vastgelegd. Als secundaire uitkomst is gekeken naar alternatieve manieren van vastleggen van de uitslag, waaronder in documenten of als laboratoriumuitslag. Ook is daarbij gekeken naar de herleidbaarheid van het advies van de apotheek, zoals dosisaanpassing, en van het beleid van de arts, waarbij gekeken is of de arts actie heeft ondernomen op basis van het advies van de apotheek.
Data-analyse
Het primaire eindpunt werd berekend door het aantal patiënten met een farmacogenetische uitslag geregistreerd als contra-indicatie in het ziekenhuisinformatiesysteem te delen door het totaal aantal geïncludeerde patiënten. De resultaten zijn per centrum geanalyseerd. Met behulp van een chi-kwadraattoets met 95%-betrouwbaarheidsinterval is gekeken of de proporties tussen de periodes statistisch significant verschilden. Ook de secundaire uitkomsten werden gerapporteerd als percentages.
Resultaten
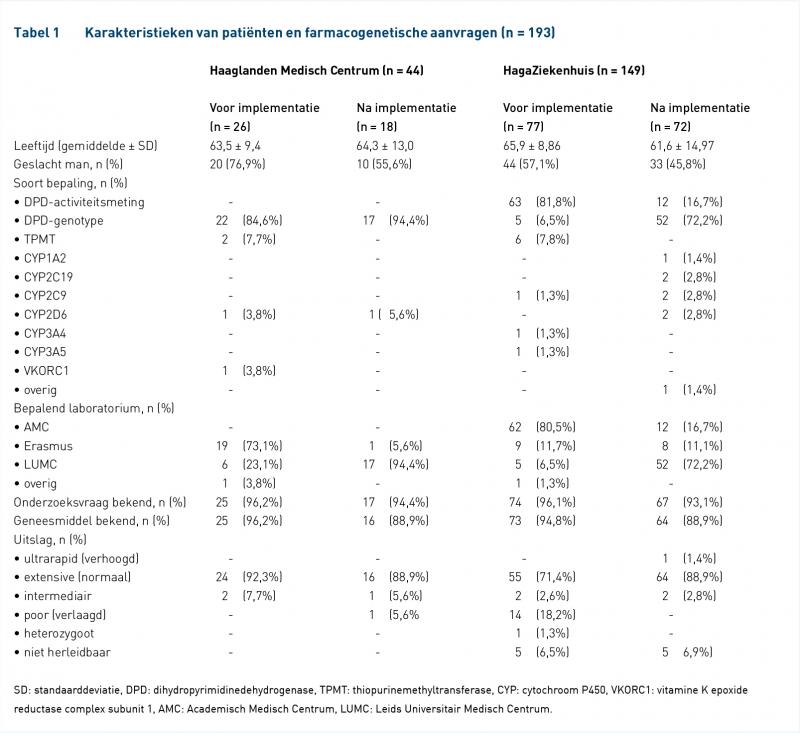
In totaal zijn 193 patiënten geïncludeerd in de twee meetperiodes. Van deze 193 patiënten zijn 103 patiënten geïncludeerd in de voormeting, en 90 patiënten in de nameting. De gemiddelde leeftijd van de gehele populatie was 63,8 jaar en 107 patiënten (55,4%) van de 193 patiënten waren man. Zowel in de voormeting als de nameting was de bepaling van DPD, waarbij de activiteitsmeting en de genotypering zijn gecombineerd, de meest voorkomende analyse in het HMC en het HagaZiekenhuis (84,6% ten opzichte van 94,4%, tegenover respectievelijk 88,3% ten opzichte van 88,9%). Genotypering van thiopurinemethyltransferase (TPMT) en CYPs werd sporadisch ingezet (15,4% ten opzichte van 5,6%, tegenover respectievelijk 11,7% ten opzichte van 11,1%). De karakteristieken zijn terug te vinden in tabel 1.
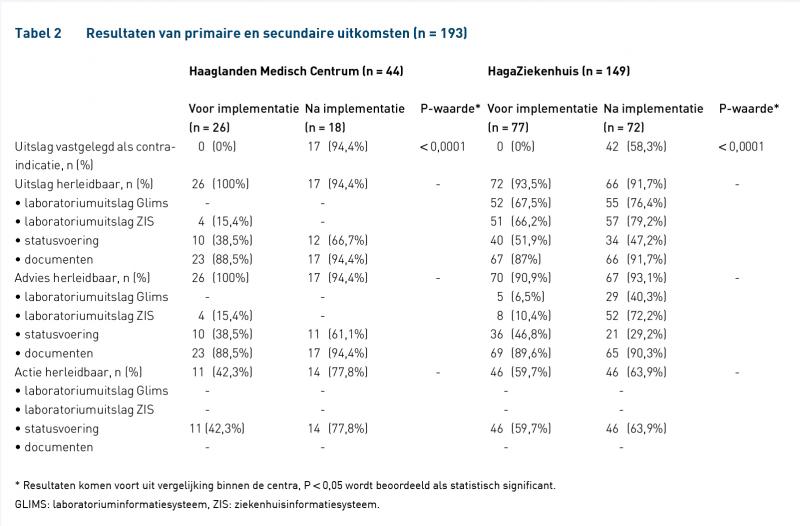
Van de respectievelijk 26 en 77 patiënten van het HMC en het HagaZiekenhuis uit de voormeting was voor geen enkele patiënt (0%) de uitslag vastgelegd als contra-indicatie in het ziekenhuisinformatiesysteem, vergeleken met 17 patiënten (94,4%) van de 18 in het HMC en 42 patiënten (58,3%) van de 72 patiënten in het HagaZiekenhuis uit de nameting (p < 0,0001 voor beide ziekenhuizen). De laatste metingen binnen de tweede periode laten echter een resultaat van 95% (38/40 patiënten) zien binnen het HagaZiekenhuis.
Bij meer dan 90% van de patiënten is een uitslag herleidbaar in het laboratorium- of ziekenhuisinformatiesysteem en bij meer dan 85% werd tevens het advies van de apotheek teruggevonden. De mate waarin de arts hier bewust beleid op heeft gevoerd is in de nameting beter geregistreerd dan in de voormeting, met name in het HMC (zie tabel 2).
Beschouwing
Door het aanpassen van de werkwijze van aanvragen tot rapportage van farmacogenetisch onderzoek is een verbetering opgetreden van respectievelijk 94,4% en 58,3% van patiënten in het HMC en HagaZiekenhuis waarbij hun farmacogenetische resultaat in het ziekenhuissysteem ingevoerd is. Daarmee is de farmacogenetische informatie beschikbaar voor interpretatie, medicatiebewaking en voor overdracht naar de eerstelijnszorg binnen het HMC en het HagaZiekenhuis.
Met een resultaat van circa 58,3% lijkt de implementatie niet volledig geslaagd in het HagaZiekenhuis. De laatste metingen laten echter een resultaat van 95% zien, waarmee geconcludeerd kan worden dat de eerste metingen van de nameting in de ingroeifase van de implementatie hebben plaatsgevonden. In het onderzoek van Simoons et al. waren enkel afwijkende uitslagen (PM, IM en UM) herleidbaar na overdracht naar de eerstelijnszorg [9]. Door het gestructureerd vastleggen van alle uitslagen, zowel wildtype als mutatie, is voor bijna alle nieuwe patiënten de farmacogenetische informatie beschikbaar voor arts en apotheek en overdraagbaar aan de eerste lijn. Bij meer dan 90% van de patiënten was de uitslag op enige manier herleidbaar, zowel voor als na implementatie. Een uitslag kan echter enkel van voordeel zijn voor de patiënt indien automatische medicatiebewaking mogelijk is.
Tussen 2015 en 2017 zijn de inzichten aanzienlijk veranderd waardoor een exponentiele groei heeft plaatsgevonden in het aantal aanvragen van DPD-genotype; van 20 bepalingen per jaar naar 20 bepalingen per maand [4]. Ondanks een kortere nameting zijn vergelijkbare aantallen patiënten geïncludeerd. Tevens heeft er een switch plaats gevonden van DPD-activiteitsmeting naar DPD-genotype als gevolg van een studie [5]. In onderzoek van Lunenburg et al. wordt bij 5,1% van de patiënten een variant gemeten, in de literatuur wordt gesproken over 4,7-8,2% [4]. In de populatie van dit onderzoek wordt voor DPD bij 9,4% van de patiënten een variant gerapporteerd, mogelijk te verklaren door kleine patiëntaantallen.
Zowel de verdeling in geslacht als leeftijd is te verklaren door de populatie waarbij de farmacogenetische status van DPD bepaald wordt. Bij coloncarcinoom, vaker voorkomend bij mannen, worden capecitabine en 5-fluorouracil al lange tijd ingezet als eerstelijnstherapie, en meer recent ook bij vrouwen met mammacarcinoom als derdelijnsbehandeling [10].
Met een aanzienlijke populatie aan patiënten met de ziekte van Crohn en colitis ulcerosa in de Haagse regio is het beperkt aantal TPMT-aanvragen opvallend. Dit kan verklaard worden door de keuze van de kliniek voor therapeutic drug monitoring, de bepaling van de metabolieten van de thiopurines (6-MMP en 6-TGN), voor de evaluatie van de therapie.
Het beschrijven en onderzoeken van een procesverbetering van farmacogenetische statusvoering binnen het ziekenhuis is niet eerder uitgevoerd. Door medicatiebewaking op individuele patiënteigenschappen kan er een toename plaatsvinden van de patiëntveiligheid, zowel binnen het ziekenhuis als bij overdracht naar de eerstelijnszorg bij ontslag, en kan deze structurele aanpak in de toekomst als basis dienen voor andere resultaten, bijvoorbeeld tumorgenetica.
Conclusie
Na implementatie van het verbeterplan heeft er een toename in vastlegging, interpretatie en bewaking plaatsgevonden van de farmacogenetische uitslagen van respectievelijk 94,4% en 58,3% binnen het HMC en het HagaZiekenhuis. Optimalisatie van het proces zal zorgen voor betere vastlegging. Verder onderzoek kan gedaan worden naar de invloed van dit verbetertraject op de medicatieveiligheid.
Verantwoording
Geen belangenverstrengeling gemeld.
Gebaseerd op het registratieonderzoek van H.L. van den Hoek.
Literatuur
1. García-González X, et al. Clinical implementation of pharmacogenetics. Drug Metabol Personal Ther. 2016;31(1):9-16.
2. Sing CW, et al. Pharmacogenomics--how close/far are we to practicing individualized medicine for children? Br J Clin Pharmacol. 2015;79(3):419-28.
3. Abul-Husn NS, et al. Implementation and utilization of genetic testing in personalized medicine. Pharmgenomics Pers Med. 2014;7:227-40.
4. Lunenburg CATC, et al. Evaluation of clinical implementation of prospective DPYD genotyping in 5-fluorouracil- or capecitabine-treated patients. Pharmacogenomics. 2016;17(7):721-9.
5. García-González X, et al. Using pharmacogenetics to prevent severe adverse reactions to capecitabine. Pharmacogenomics. 2017;18(13):1199-1213.
6. Finkelstein J, et al. Pharmacogenetic polymorphism as an independent risk factor for frequent hospitalizations in older adults with polypharmacy: a pilot study. Pharmgenomics Pers Med. 2016;9:107-116.
7. Sugarman EA, et al. Contribution of pharmacogenetic testing to modeled medication change recommendations in a long-term care population with polypharmacy. Drugs Aging. 2016 Dec;33(12):929-936.
8. G-standaard transparantiedocument: Farmacogenetica. KNMP; 2018. Beschikbaar op: https://www.knmp.nl/patientenzorg/medicatiebewaking/farmacogenetica [geraadpleegd: 18 februari 2016].
9. Simoons M, et al. Availability of CYP2D genotyping results in general practitioner and community pharmacy medical records. Pharmacogenomics. 2017 Jun;18(9):843-851.
10. Oncoline: richtlijnen voor oncologische zorg. Intergraal Kankercentrum Nederland; 2018. Beschikbaar op: http://www.oncoline.nl/index.php [geraadpleegd: 13 oktober 2017].
Referentie
Citeer als: Van den Hoek HL, Roelofsen EE, Verheul R, Veuger M, Wilms EB, Visser LE. Dossiervoering van farmacogenetische uitslagen: een implementatieonderzoek in de Haagse regio. Nederlands Platform voor Farmaceutisch Onderzoek. 2018;3:a1674.
DOI
https://www.knmp.nl/resolveuid/952524e777794ab892b995238787399eOpen access


Reactie toevoegen