De ontwikkeling van budesonidetabletten met nulde-orde-afgifte voor de behandeling van ileo-colonische inflammatoire darmziekten en vergelijking met huidige, commerciële preparaten
- Rubriek: Korte bijdrage
- Identificatie: 2019;4:a1715
Kernpunten
- Voor een effectieve behandeling met topisch werkzame geneesmiddelen in de darm is het noodzakelijk deze te richten op het gebied dat behandeling vereist.
- In vitro- en klinische data laten zien dat de commerciële, orale budesonideformuleringen suboptimaal zijn voor de behandeling van inflammatoire darmziekten in zowel het ileum als colon.
- Een gewenst afgifteprofiel voor de behandeling van ontstekingen in zowel ileum als colon wordt verkregen door de ColoPulse-coating en een tabletkern met gereguleerde afgifte.
Abstract
Development of novel zero-order release budesonide tablets for the treatment of ileo-colonic inflammatory bowel disease and comparison with formulations currently used in clinical practice
BACKGROUND
In patients with inflammatory bowel disease, the terminal ileum and colon is the most affected region. Oral budesonide is an effective treatment but in vitro as well as clinical data suggest that the formulations currently used in clinical practice are suboptimal to treat the entire ileo-colonic region.
OBJECTIVE and DESIGN
The aim of this in vitro study was to develop ileo-colonic-targeted zero-order sustained-release tablets containing 3 mg or 9 mg budesonide (ColoPulse 3 mg and 9 mg, respectively).
METHODS
Tablets were tested in a 10 hour gastrointestinal simulation system for site-specific release, zero-order release kinetics (R2 ≥ 0.95), release rate, and completeness of release (≥ 80%). Release profiles of the novel formulations were compared with Entocort, Budenofalk, and Cortiment (budesonide MMX).
RESULTS
None of these formulations currently used in clinical practice targeted the entire ileo-colonic region. However, ColoPulse 3 mg and 9 mg were targeted to the ileum, released the entire dose with zero-order release kinetics in the ileo-colonic region, and complied with a 6-month accelerated stability study.
CONCLUSION
Therefore, ColoPulse 3 mg and 9 mg are novel, interesting formulations for the treatment of the entire ileo-colonic region in inflammatory bowel disease.
Inleiding
De ziekte van Crohn (CD) en colitis ulcerosa (UC) zijn inflammatoire darmziekten (IBD) en worden gekenmerkt door perioden van opvlammingen van ontsteking. UC betreft ontsteking van het colon terwijl de ontsteking bij CD in het gehele maagdarmstelsel (GIT) kan voorkomen. Bij ongeveer 50% van de IBD-patiënten zijn het ileum en colon betrokken [1,2]. De exacte pathogenese is onbekend, maar verondersteld wordt dat door omgevingsfactoren een afwijkende immuunrespons tegen de commensale microflora ontstaat in patiënten met een genetische gevoeligheid hiervoor. Deze ontsteking geeft aanleiding tot zweren waardoor een grotere blootstelling aan de microflora ontstaat. Hierdoor ontstaat een vicieuze cirkel van de immuunrespons [1,3-5]. Anti-inflammatoire en immunosuppressieve geneesmiddelen zijn derhalve effectief in de behandeling van IBD.
De eerstelijnstherapie voor mild-tot-matige CD is orale budesonide. Deze therapie wordt alleen in UC geadviseerd wanneer aminosalicylaattherapie faalt [6,7]. Budesonide is door het grote first pass-metabolisme voornamelijk topisch werkzaam en induceert lokaal een anti-inflammatoire respons. Om lokale budesonideconcentraties in het GIT te verwezenlijken, moet de afgifte gericht en gereguleerd zijn [8-10]. Commerciële preparaten gebruiken verschillende technieken om dit doel te bereiken (tabel 1; [11-13]). Zowel in vitro- als klinische data laten zien dat de huidige formuleringen suboptimaal zijn om het hele ileum en colon te behandelen.
De ColoPulse-technologie is een coating die orale formuleringen specifiek kan richten tot het ileum en colon. Dit is aangetoond in zowel in vitro- als klinische onderzoeken [14-20].
Het doel van dit in vitro-onderzoek was de ontwikkeling van budesonidetabletten van 3 mg en 9 mg die specifiek het hele ileum en colon behandelen bij IBD (tabel 2). Deze nieuwe formuleringen werden vergeleken met de huidige, commerciële formuleringen.
Methoden
Onderzoeksopzet
Voor een volledige beschrijving van de gebruikte grondstoffen en experimenten wordt verwezen naar het originele onderzoek [21]. De formulering met het juiste afgifteprofiel en specificaties (tabel 2) werd verkregen door eerst het afgifteprofiel van ongecoate tabletkernen met 9 mg budesonide te optimaliseren in fosfaatbuffer pH 6, de veronderstelde pH van het colon [22-26]. Vervolgens werd 3 mg budesonide aan de formulering toegevoegd. Daarna werden de tabletkernen gecoat met de ColoPulse-coating en werd het afgifteprofiel onderzocht in een maag-darmsimulatiesysteem (GISS) en vergeleken met de commerciële preparaten (tabel 1). Tevens werd een versneld stabiliteitsonderzoek uitgevoerd.
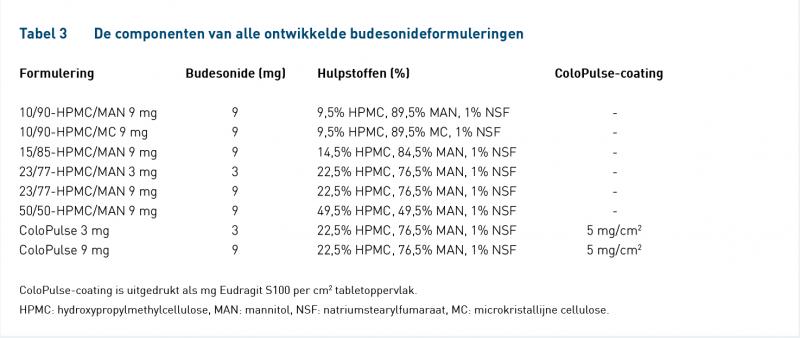
Tabel 3 geeft de samenstelling weer van alle ontwikkelde formuleringen. Hydroxypropylmethylcellulose (HPMC) werd gebruikt als gelvormer voor de gereguleerde afgifte van budesonide. Mannitol (MAN) en cellulose (MC) werden gebruikt als respectievelijk wateroplosbare en niet-wateroplosbare hulpstoffen. Natriumstearylfumaraat (NSF) werd gebruikt als glijmiddel. De ColoPulse-coating werd gebruikt om de tabletten te richten tot het ileo-colonische gebied.
GISS
Het GISS simuleert in vitro de maagdarmpassage door gebruik te maken van verschillende buffers van verschillende pH’s die stapsgewijs aan het dissolutiemedium worden toegevoegd. Het initiële dissolutievolume was 500 mL en het eindvolume was 1000 mL [21,22].
Resultaten
Tabletkernen
Figuur 1 laat de afgifteprofielen zien van de ontwikkelde formuleringen in pH 6 en tabel 4 geeft de afgifte-eigenschappen weer. De afgiftesnelheid kon gereguleerd worden door de hulpstoffen te variëren. De afgifte van 23/77-HPMC/MAN 9 mg voldeed aan de eisen omdat deze compleet (81%) en nulde-orde was (R2 = 0,954). Toevoeging van 3 mg budesonide aan deze formulering – 23/77-HPMC/MAN 3 mg – liet tevens een gelijkwaardige, complete (100%) en nulde-orde-afgifte zien (R2 = 0,989). Deze formuleringen werden gecoat met de ColoPulse-coating, resulterend in ColoPulse 3 mg en ColoPulse 9 mg.
GISS
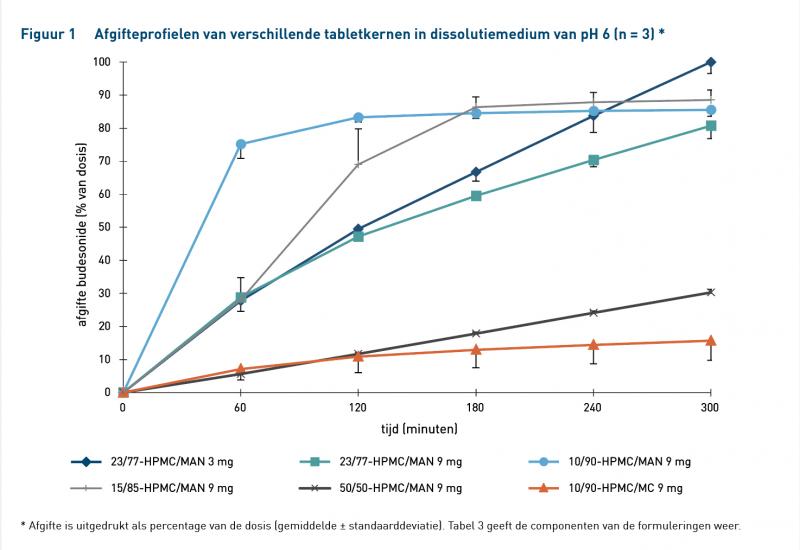
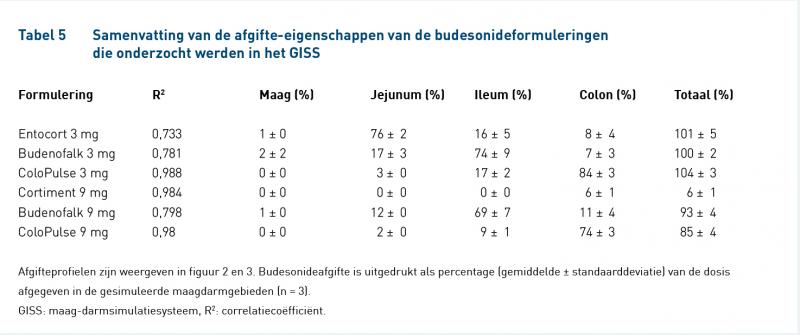
Figuur 2 laat de afgifteprofielen zien van ColoPulse 3 mg, Entocort 3 mg en Budenofalk 3 mg en tabel 5 geeft de afgifte-eigenschappen weer. Budesonideafgifte van ColoPulse 3 mg begon in het ileum en budesonide werd volledig afgegeven met nulde-ordekinetiek in het hele ileo-colonische gebied. Van de dosis werd respectievelijk 17% en 84% afgegeven in het ileum en colon. Budesonideafgifte van Entocort 3 mg begon in het jejunum en was niet nulde-orde. Afgifte was compleet (101%), maar slechts 24% werd afgegeven in het ileo-colonische gebied. Budesonideafgifte van Budenofalk 3 mg begon gereguleerd in het jejunum. De afgifte was echter onmiddellijk in het ileum, waarbij 74% ineens werd afgegeven; er werd geen substantiële afgifte geobserveerd in het colon.
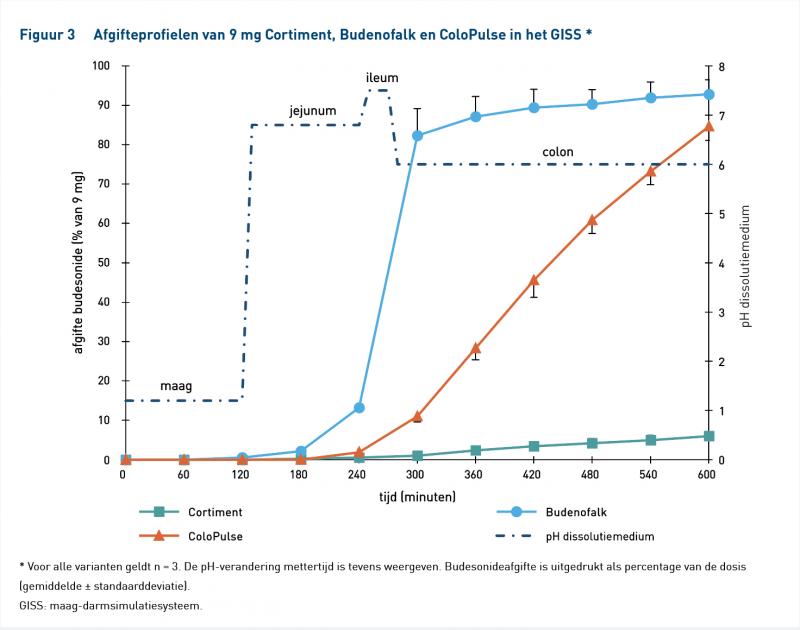
Figuur 3 laat de afgifteprofielen zien van ColoPulse 9 mg, Budenofalk 9 mg en Cortiment 9 mg en tabel 5 geeft de afgifte-eigenschappen weer. Ook de afgifte van ColoPulse 9 mg begon in het ileum, was nulde-orde en compleet. Budenofalk 9 mg had ook een gelijkwaardig afgifteprofiel als de 3 mg-formulering. Cortiment 9 mg had een traag en incompleet afgifteprofiel, alhoewel de afgifte nulde-orde was. Slecht 6% van de dosis werd afgegeven aan het einde van het experiment en 20% na 24 uur in het GISS (gegevens niet getoond).
Versneld stabiliteitsonderzoek
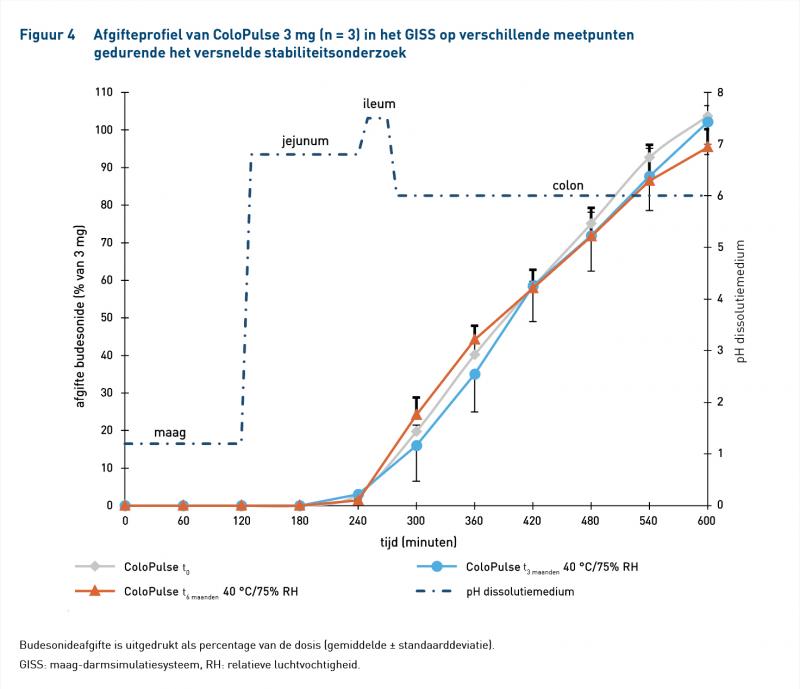
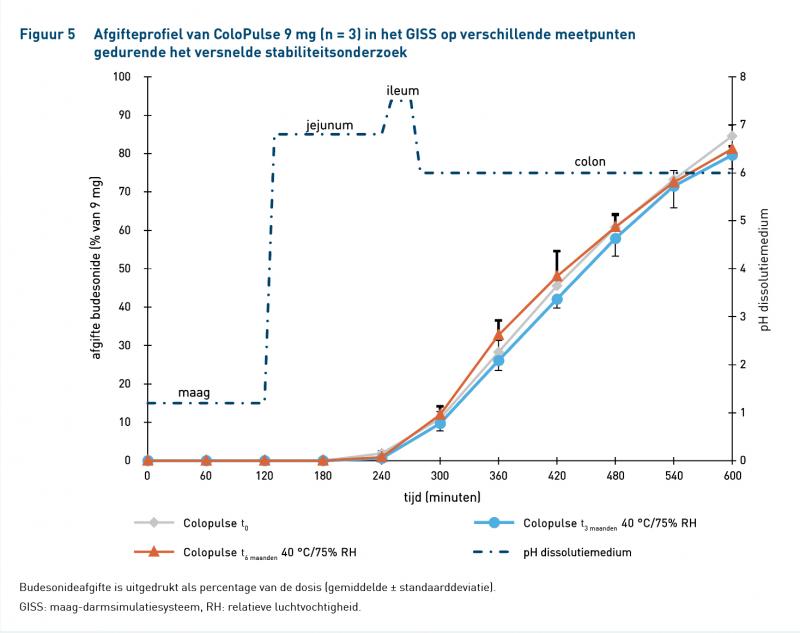
Figuren 4 en 5 laten de afgifteprofielen zien van ColoPulse 3 mg en 9 mg gedurende het versnelde stabiliteitsonderzoek en tabel 6 geeft de afgifte-eigenschappen weer. Beide formuleringen voldeden aan alle eisen voor afgifte en gehalte op t0, t3 en t6 maanden (tabel 2).
Beschouwing
ColoPulse 3 mg en 9 mg lieten een gewenst in vitro-afgifteprofiel zien met het oog op de behandeling van het ileum en colon. De afgifte uit beide formuleringen was gelijkwaardig en begon in het ileum met een constante, nulde-ordekinetiek totdat de afgifte compleet was. Ook voldeden beide formuleringen aan de eisen van het versnelde stabiliteitsonderzoek. Deze data laten zien dat de ColoPulse 3 mg en 9 mg interessante formuleringen zijn om klinisch te onderzoeken. De formuleringen zijn met name interessant voor linkszijdige UC aangezien de afgiftesnelheid constant was gedurende de passage in het ileum en colon. Linkszijdige UC wordt momenteel behandeld met klysma’s en een orale toedieningsvorm verbetert mogelijk de patiëntvriendelijkheid en daarmee de therapietrouw, gezien klysma’s zijn geassocieerd met een verlaagde therapietrouw [7].
De in vitro-data lieten ook zien dat de huidige, commerciële budesonideformuleringen niet geschikt zijn om het hele ileo-colonische gebied te behandelen. Budenofalk 3 mg en 9 mg hadden een gelijkwaardig afgifteprofiel gekenmerkt door substantiële afgifte voor het ileum, waarna het grootste deel van de dosis ineens werd afgegeven in het ileum; afgifte in het colon was verwaarloosbaar. Zowel gelijkwaardige in vitro- als klinische data zijn elders beschreven, waardoor deze formulering geschikt is voor de behadeling van het ileum en proximale colon [28,30], Dit is in overeenstemming met de indicatie.
Het grootste deel van Entocort 3 mg werd afgegeven in het jejunum en slechts een klein deel bereikte het ileum en colon. Deze in vitro-data zijn eerder beschreven [28,29]. Klinische data laten echter zien dat 40% van de dosis in het ileum en proximale colon werd geabsorbeerd [27]. Desalniettemin is 40% absorptie in deze delen suboptimaal voor de behandeling van het hele ileo-colonische gebied. Dit suggereert dat Entocort 3 mg geschikt is voor de behandeling van het jejunum, ileum en/of proximale colon, wat deels in overeenstemming is met de indicatie aangezien het niet is geregistreerd voor de behandeling van het jejunum.
De afgifte van Cortiment 9 mg was het traagst en incompleet. Gelijkwaardige in vitro-resultaten zijn elders beschreven [29]. Deze formulering bestaat uit lipofiele en hydrofiele componenten (MMX-matrix) om de afgifte te reguleren. Verondersteld wordt dat het zeer lipofiele budesonide in de lipofiele componenten van de tabletkern achterblijft in plaats van oplost in het waterige milieu. Deze veronderstelling wordt ondersteund door data die laten zien dat mesalazine – een goed wateroplosbaar geneesmiddel – wel snel en compleet oplost uit dezelfde MMX-matrix [20].
Cortiment 9 mg tracht het hele colon te behandelen. De langzame, incomplete afgiftesnelheid lijkt onvoldoende om het ontstekingsgebied effectief te behandelen; temeer omdat passagesnelheid in IBD versneld kan zijn. Klinische data laten zien dat in slechts 42% van de gezonde vrijwilligers de afgifte in het ileum begon en dat de geabsorbeerde dosis sterk varieerde en vaak incompleet was [31]. Klinische werkzaamheid is aangetoond in UC, maar in deze studies werd Cortiment 9 mg vergeleken met Asacol, Entocort en placebo [33,34]. De werkzaamheid was bescheiden en afgevraagd kan worden waarom in deze studies Cortiment 9 mg werd vergeleken met een lage dosis Asacol – afwijkend van Cochrane-richtlijnen – of een budesonideformulering met een volledig ander afgifteprofiel (figuren 2 en 3; [11,35,36]). Deze formulering lijkt derhalve suboptimaal te zijn voor de behandeling van het hele terminale ileum en colon.
Het GIT is zeer complex en wordt sterk beïnvloed door vele factoren zoals de microflora, leeftijd, geslacht, ziekten, geneesmiddelen en voeding. Passagetijd en compositie van de maag-darmvloeistoffen – en daarmee ook de pH – is zeer variabel [23-26,37-40]. Dit maakt het onmogelijk om de maag-darmpassage accuraat te simuleren met een in vitro-model. Derhalve is onze studie gelimiteerd, omdat er gebruik werd gemaakt van een simpel in vitro-model. Dit model weerspiegelt niet accuraat het complexe GIT. Een dergelijk model is echter goed inzetbaar tijdens de eerste fase van formuleringsonderzoek om algemene vergelijkingen te maken.
Conclusie
Gebaseerd op in vitro-data zijn de ColoPulse 3 mg en 9 mg nieuwe en interessante budesonideformuleringen voor de behandeling van het hele ileo-colonische gebied in IBD en zijn ze potentieel beter dan commercieel beschikbare budesonideformuleringen voor de behandeling van linkszijdige UC.
Verantwoording
Geen belangenverstrengeling gemeld.
Gebaseerd op het registratieonderzoek van B. Gareb.
Dit artikel is een vertaling van: Gareb B, Dijkstra G, Kosterink JGW, Frijlink HW. Development of novel zero-order release budesonide tablets for the treatment of ileo-colonic inflammatory bowel disease and comparison with formulations currently used in clinical practice. Int J Pharm. 2019 Jan 10;554:366-375. doi: 10.1016/j.ijpharm.2018.11.019.
Literatuur
1. Ungaro, R., Mehandru, S., Allen, P. B., Peyrin-Biroulet, L. & Colombel, J. F. Ulcerative colitis. Lancet 389, 1756–1770 (2017).
2. Peppercorn, M. A. & Kane, S. V. Clinical manifestations, diagnosis and prognosis of Crohn disease in adults. UpToDate (2018). Available at (accessed 12 March 2018): https://www.uptodate.com/contents/clinical-manifestations-diagnosis-and-prognosis-of-crohns-disease-in-adults
3. Baumgart, D. C. & Sandborn, W. J. Crohn’s disease. Lancet 380, 1590–605 (2012).
4. Danese, S. & Fiocchi, C. Ulcerative Colitis. N. Engl. J. Med. 365, 1713–1725 (2011).
5. Abraham, C. & Cho, J. H. Inflammatory Bowel Disease. N Engl J Med 361, 2066–78 (2009).
6. Gomollón, F. et al. 3rd European evidence-based consensus on the diagnosis and management of Crohn’s disease 2016: Part 1: Diagnosis and medical management. J. Crohn’s Colitis 11, 3–25 (2017).
7. Harbord, M. et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: Current management. J. Crohn’s Colitis 11, 769–784 (2017).
8. Rhen, T. & Cidlowski, J. A. Antiinflammatory Action of Glucocorticoids — New Mechanisms for Old Drugs. N. Engl. J. Med. 353, 1711–1723 (2005).
9. Clark, A. R. Anti-inflammatory functions of glucocorticoid-induced genes. Mol. Cell. Endocrinol. 275, 79–97 (2007).
10. Prantera, C. Glucocorticosteroids in the treatment of inflammatory bowel disease and approaches to minimizing systemic activity. Therap. Adv. Gastroenterol. 6, 137–156 (2013).
11. Sherlock, M. E., MacDonald, J. K., Griffiths, A. M., Steinhart, A. H. & Seow, C. H. Oral budesonide for induction of remission in ulcerative colitis. Cochrane Database Syst. Rev. CD007698 (2015). doi:10.1002/14651858.CD007698.pub3.
12. Kuenzig, M. et al. Budesonide for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev. CD002913 (2014). doi:10.1002/14651858.CD002913.pub3.
13. Rezaie, A. et al. Budesonide for induction of remission in Crohn’s disease. Cochrane Database Syst. Rev. CD000296 (2015). doi:10.1002/14651858.CD000296.pub4.
14. Schellekens, R. C. A. et al. Proof-of-concept study on the suitability of 13C-urea as a marker substance for assessment of in vivo behaviour of oral colon-targeted dosage forms. Br. J. Pharmacol. 158, 532–540 (2009).
15. Maurer, J. M. et al. ColoPulse tablets perform comparably in healthy volunteers and Crohn’s patients and show no influence of food and time of food intake on bioavailability. J. Control. Release 172, 618–624 (2013).
16. Schellekens, R. C. A. et al. Oral ileocolonic drug delivery by the colopulse-system: A bioavailability study in healthy volunteers. J. Control. Release 146, 334–340 (2010).
17. Maurer, M. J. M. et al. A non-invasive, low-cost study design to determine the release profile of colon drug delivery systems: a feasibility study. Pharm. Res. 29, 2070–8 (2012).
18. Maurer, J. M. et al. Gastrointestinal pH and transit time profiling in healthy volunteers using the IntelliCap system confirms ileo-colonic release of ColoPulse tablets. PLoS One 10, e0129076 (2015).
19. Schellekens, R. C. A. et al. Pulsatile drug delivery to ileo-colonic segments by structured incorporation of disintegrants in pH-responsive polymer coatings. J. Control. Release 132, 91–98 (2008).
20. Gareb, B., Eissens, A. C., Kosterink, J. G. W. & Frijlink, H. W. Development of a zero-order sustained-release tablet containing mesalazine and budesonide intended to treat the distal gastrointestinal tract in inflammatory bowel disease. Eur. J. Pharm. Biopharm. 103, 32–42 (2016).
21. Gareb, B., Dijkstra, G., Kosterink, J. G. W. & Frijlink, H. W. Development of novel zero-order release budesonide tablets for the treatment of ileo-colonic inflammatory bowel disease and comparison with formulations currently used in clinical practice. Int. J. Pharm. 554, (2019).
22. Schellekens, R. C. A., Stuurman, F. E., van der Weert, F. H. J., Kosterink, J. G. W. & Frijlink, H. W. A novel dissolution method relevant to intestinal release behaviour and its application in the evaluation of modified release mesalazine products. Eur. J. Pharm. Sci. 30, 15–20 (2007).
23. McConnell, E. L., Fadda, H. M. & Basit, A. W. Gut instincts: Explorations in intestinal physiology and drug delivery. Int. J. Pharm. 364, 213–226 (2008).
24. Press, A. G. et al. Gastrointestinal pH profiles in patients with inflammatory bowel disease. Aliment. Pharmacol. Ther. 12, 673–8 (1998).
25. Nugent, S. G., Kumar, D., Rampton, D. S. & Evans, D. F. Intestinal luminal pH in inflammatory bowel disease: possible determinants and implications for therapy with aminosalicylates and other drugs. Gut 48, 571–577 (2001).
26. Freire, A. C., Basit, A. W., Choudhary, R., Piong, C. W. & Merchant, H. A. Does sex matter? The influence of gender on gastrointestinal physiology and drug delivery. Int. J. Pharm. 415, 15–28 (2011).
27. SmPC. Summary of Product Characteristics Entocort 3 mg. Tillotts Pharma (2017).
28. Klein, S., Stein, J. & Dressman, J. Site-specific delivery of anti-inflammatory drugs in the gastrointestinal tract: an in vitro release model. J. Pharm. Pharmacol. 57, 709–719 (2005).
29. Goyanes, A. et al. Fabrication of controlled-release budesonide tablets via desktop (FDM) 3D printing. Int. J. Pharm. 496, 414–420 (2015).
30. SmPC. Summary of Product Characteristics Budenofalk 3 mg. Dr Falk Pharma (2017).
31. Brunner, M. et al. Gastrointestinal transit, release and plasma pharmacokinetics of a new oral budesonide formulation. Br. J. Clin. Pharmacol. 61, 31–38 (2006).
32. Ph. Eur. Recommendations on Dissolution Testing. (2018). Available at (accessed 16 July 2018): https://www-pharmacopoeia-com.proxy-ub.rug.nl/bp-2018/appendices/appendix-12/appendix-xii-b--annex--recommendations-on-dissolution-testing.html?date=2018-07-01&text=recommendations+on+dissolution+testing
33. Balzola, F., Cullen, G., Ho, G. T., Russell, R. K. & Wehkamp, J. Once-daily budesonide MMX(R) extended-release tablets induce remission in patients with mild to moderate ulcerative colitis: results from the CORE I study. Gastroenterology 143, 1218–1226 (2012).
34. Travis, S. P. L. et al. Once-daily budesonide MMX in active, mild-to-moderate ulcerative colitis: results from the randomised CORE II study. Gut 63, 433–441 (2014).
35. Prantera, C. & Scribano, M. L. Budesonide multi-matrix system formulation for treating ulcerative colitis. Expert Opin. Pharmacother. 15, 741–743 (2014).
36. Prantera, C. Letter: Budesonide MMX for ulcerative colitis? Aliment. Pharmacol. Ther. 39, 1435 (2014).
37. Varum, F. J. O., Hatton, G. B. & Basit, A. W. Food, physiology and drug delivery. Int. J. Pharm. 457, 446–460 (2013).
38. Haase, A. M. et al. Regional gastrointestinal transit times in severe ulcerative colitis. Neurogastroenterol. Motil. 28, 217–24 (2016).
39. Graff, J., Brinch, K. & Madsen, J. L. Gastrointestinal mean transit times in young and middle-aged healthy subjects. Clin. Physiol. 21, 253–259 (2001).
40. Sjögren, E. et al. In vivo methods for drug absorption – Comparative physiologies, model selection, correlations with in vitro methods (IVIVC), and applications for formulation/API/excipient characterization including food effects. Eur. J. Pharm. Sci. 57, 99–151 (2014).
Referentie
Citeer als: Gareb B, Dijkstra G, Kosterink JGW, Frijlink HW. De ontwikkeling van budesonidetabletten met nulde-orde-afgifte voor de behandeling van ileo-colonische inflammatoire darmziekten en vergelijking met huidige, commerciële preparaten. Nederlands Platform voor Farmaceutisch Onderzoek. 2019;4:a1715.
DOI
https://www.knmp.nl/resolveuid/1b651e7a446e4f6d899df3bac4c85b62Open access





Reactie toevoegen